Текст научной статьи на тему «СРАВНЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК ДЕСОРБЦИИ И ИОНИЗАЦИИ ГАЛОГЕНИДОВ СЕРЕБРА С ПОВЕРХНОСТЕЙ НЕРЖАВЕЮЩЕЙ СТАЛИ И АЛЮМИНИЕВЫХ МАТЕРИАЛОВ ПО ДАННЫМ МАСС-СПЕКТРОМЕТРИИ»
ФИЗИКОХИМИЯ ПОВЕРХНОСТИ И ЗАЩИТА МАТЕРИАЛОВ, 2014, том 50, № 1, с. 94-98
Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии им. А.Н. Фрумкина РАН, 117071, Москва, Ленинский пр-т, д. 31
В работе масс-спектрометрическим методом показано различие энергетических и кинетических характеристик ионизации галогенидов серебра с различных поверхностей. Для этого исследована ионизация кластеров галогенидов серебра с поверхностей стандартной мишени из полированной нержавеющей стали компании «ВКиКЕК» в сравнении с алюминиевыми материалами АМг-6 и Ад-0.
Показано, что, несмотря на меньшую удельную энергию ионизации, шероховатая поверхность сильно затрудняет испарение и десорбцию и как следствие, ухудшает эффективность сублимации и десорбции вещества. Кроме того, шероховатая поверхность вызывает неравномерное распределение энергии по поверхности и неравномерный разогрев, что также ухудшает эффективность ионизации. Показано также, что геометрия поверхности влияет на термодинамику и кинетику процессов образования и фрагментации ионов. На шероховатых поверхностях энергии образования ионов в 1.5—2 раза больше, чем на полированной, набор ионов и энергетические промежутки их существования значительно шире.
Серебро из ~ 67,5 грамм ЖИРНИХ КМ конденсаторов
Важным аспектом современных фундаментальных исследований является определение термодинамических характеристик различных процессов: адсорбции, ионизации и других [1—5]. Поиск зависимости процессов десорбции и ионизации от типа поверхности является фундаментальной задачей химии поверхности.
Масс-спектрометрия с лазерной ионизацией позволяет определять ряд характеристик ионизации: энергия начала ионизации, минимальное количество ионизируемых молекул, энергии образования кластеров и другие. В настоящей работе исследована ионизация кластеров галогенидов серебра с поверхностей стандартной мишени из полированной нержавеющей стали компании «ВЯиКЕЯ» в сравнении с алюминиевыми материалами АМг-6 и Ад-0. Исследуемые поверхности принципиально отличаются морфологией и химией поверхности, которые могут влиять на эффективность ионизации. Целью работы является определение энергий начала ионизации, минимального количества ионизируемых молекул и установление их зависимости от условий эксперимента — энергии и мощности ионизирующего излучения, концентрации вещества на поверхности.
Для исследования использовали масс-спектрометр МАЛДИ «Вгакег Вакошс8 ШгаЯех II» с ионизацией азотным лазером и рабочей длиной волны 337 нм. Энергия лазера варьировалась от 10 до 150 мкДж/импульс. Частота импульсов составляла 20 Гц. Количество импульсов варьировалась от 1 до 100.
Для нанесения веществ на исследуемые поверхности на этих поверхностях синтезировали водные суспензии хлорида, бромида или иодида серебра путем смешения раствора нитрата серебра с соответствующим галогенидом калия. Концентрации растворов нитрата серебра варьировались от 10-15 до 10-8 моль/л, концентрации галогенидов были одинаковыми и составляли 10-2 моль/л, что было сделано для полного перехода серебра в галогенид.
Серебро из 5 кг конденсаторов
Поверхность полированной нержавеющей стали являлась стандартной мишенью для образцов и поставлялась компанией «Вгакег». Поверхности реальных образцов представляли из себя алюминиевые материалы марок АМг-6 и Ад-0.
Концентрация галогенидов на поверхности указана в таблице 1.
Таблица 1. Концентрация галогенидов на исследуемые поверхности
Концентрация Стандартная мишень из полированной нержавеющей стали компании «Вгакег» АМг-6 Ад-0
нитрата серебра, моль/л Поверхностная плотность, молекул/мм2 Доля монослоя Плотность, молекул/мм2 Доля монослоя Поверхностная плотность, молекул/мм2 Доля монослоя
10-15 103 10-10 10 10-12 10 10-12
10-14 104 10-9 102 10-11 102 10-11
10-13 105 10-8 103 10-10 103 10-10
10-12 106 10-7 104 10-9 104 10-9
10-11 107 10-6 105 10-8 105 10-8
10-10 108 10-5 106 10-7 106 10-7
10-9 109 10-4 107 10-6 107 10-6
10-8 1010 10-3 108 10-5 108 10-5
1. Качественный состав масс-спектров
В работе [6] показано, что масс-спектры состоят из пиков, соответствующих кластерным ионам типа Л§+[Л§На1]п и [Л§На1]пНа1~, где число п может меняться от 0 до 9. Кроме этого в масс-спектрах обнаружено множество продуктов ион-молекулярных реакций в плазме и на поверхности. Эти продукты указаны в табл. 2.
Из таблицы видно, что помимо постоянно присутствующих в масс-спектрах кластерных ионов, описанных выше, в них присутствует также ионы от примесей. Это ассоциаты кластеров серебра и его галогенидов с водой, галогенводородными, кис-лородосодержащими галогеновыми кислотами и их калиевыми и натриевыми солями, образовавшимися в результате межмолекулярных реакций при ионизации на поверхности и в источнике ионов.
3. Влияние мощности излучения на ионизацию галогенидов серебра
Пусть E — энергия одного импульса лазерного излучения, T — время одного импульса, а t — временной промежуток между импульсами, тогда суммарная мощность N выстрела из п импульсов описывается выражением:
N = п*Е/(п*Т + (п — 1)*0. (1)
Выражение (2) имеет резкий ниспадающий характер и при п ^ да, N ^ Е//. Так при п = 1 N =30 кВт, однако, уже при п = 3-4 значение N находится в пределах 3-4 мВт и практически не меняется и асимптотически стремится к значению порядка 3 мВт. Учитывая, что наша работа проводилась при п > 10, то можно утверждать, что из-за малого изменения мощности данный параметр практически не влиял на эксперимент.
2. Предел ионизации галогенидов
Качественное исследование масс-спектров ионизации с поверхностей Ад-0 и АМг-6 описано в работах [7-8].
Из табл. 3 видно, что на шероховатых поверхностях значительно ухудшается чувствительность (на три порядка), что в тоже время значительно уменьшает энергию ионизации на одну молекулу. Таким образом, неровности поверхности значительно ухудшают ионизацию, но за счет увеличения концентрации на шероховатой поверхности, удельная энергия ионизации значительно ниже, чем на полированной поверхности.
4. Энергетика образования кластерных ионов галогенидов серебра
На рис. 1 показан пример зависимости интенсивности пика соответствующего иона от энергии лазерного излучения. Можно видеть, что кла-стерообразование зависит от размеров кластера. Так для кластеров с п = 1 и 2 наблюдается перегрузка детектора при значениях энергии 3000 и 4000 мкДж.
При увеличении энергии для кластера с п = 1 наблюдается падение сигнала с энергии 6500 мкДж, что может объясняться начинающимися при таких энергиях процессами распада. Для больших кластерных ионов энергии образования еще больше. Однако следует заметить, что для всех материалов такие зависимости имеют ку-
Таблица 2. Состав ионов в масс-спектрах галогенидов серебра (m/z и брутто-формулы)
Анализируемые соединения Предполагаемые составы положительных ионов Предполагаемые составы отрицательных ионов
Брутто формула m/z Брутто формула m/z
Хлорид серебра К+ 39 С1- 35
К+[К^03] 140 ^а*КС1]а- 253
167 [^2а2*Н2су*Н20]сг 413
К+[^2С12*НС1] 364 557
н+АзС13*на] 467 Ag- 648
Источник: naukarus.com
Модуль 4 соединения с неметаллами, комплексные и металлоорганические соединения
-свойства комплексных соединений: гибридизация центрального атома, строение, типы связей, проявления эффекта Яна-Теллера, хелаты, устойчивость комплексов, химические свойства, методы получения, применение;
-металлоорганические соединения: электронное строение, типы связи, устойчивость, свойства, применение.
УЭ-1. Свойства галогенидов d-элементов I группы.
AgF, бесцв., tпл = 435 о С
CuCl, бесцв., tпл = 450 о С
AgCl, бесцв., tпл = 455 о С
AuCl, св.-жел., tразл = 420 о С
CuBr, бесцв., tпл = 504 о С
AgBr, желтов., tпл = 434 о С
CuI, бесцв., tпл = 605 о С
AgI, жел., tпл = 560 о С
а) Степень окисления +1.
CuX – бесцветные кристаллические вещества (CuF не существует), плохорастворимые в воде:
Ks(CuCl) = 1,2 * 10 -6 ; Ks(CuBr) = 5 * 10 -9 ; Ks(CuI) = 1,1 * 10 -12 .
Их переводят в раствор комплексообразованием:
CuBr + HBr (конц.) = H[CuBr2];
Растворы аммиакатов и галогенидных комплексов окисляются на воздухе:
Это можно использовать для поглощения кислорода из смеси газов (например, при очистке азота от примеси O2).
CuX дают комплексы и с другими нейтральными лигандами (главным образом мягкими): R2S, R3N, R3P…
AgX – плохорастворимы, за исключением фторида:
Это используется в аналитической химии для качественного и количественного определения галогенид-ионов и ионов серебра в водных растворах.
Галогениды серебра различаются по растворимости в водном аммиаке:
AgCl растворяется хорошо, AgBr – частично, AgI не растворяется.
? Почему так происходит? (подсказка: сравните концентрации Ag + в насыщенных растворах солей)
Йодид серебра, однако, переходит в раствор под действием тиосульфат- и цианид-ионов. Это связано с большей (по сравнению с аммиакатом) устойчивостью образующихся комплексов.
? Приведите уравнения этих реакций.
AgX также растворяются в концентрированных растворах HX и M I X:
Хлорид, бромид и йодид серебра под действием света разлагаются на элементы; это явление используется более 150 лет в процессе серебряной (чёрно-белой) фотографии.
AuX – плохорастворимые, малоустойчивые кристаллические вещества.
Весьма склонны к комплексообразованию с галогенид-ионами, органическими фосфинами, тиоэфирами R2S и другими мягкими лигандами. Растворяются также в присутствии цианид-, роданид- и тиосульфат-ионов, образуя соответствующие анионные комплексы.
Диспропорционируют под действием влаги, особенно при нагревании:
Уже при слабом нагревании AuX распадаются на простые вещества.
Получение галогенидов M(I):
? Ag2O + HF ? Ag + I2
? AgNO3 + HCl ? AuCl3
б) Степень окисления +2
Дигалогениды меди CuX2 – кристаллические вещества (CuI2 не описан в литературе).
Дийодид меди невозможно синтезировать в водной среде:
2 Cu 2+ + 4 I — 2CuI + I2.
? Объясните, почему эта реакция не протекает в обратном направлении, хотя E o (Cu 2+ /Cu + ) = 0,15 B, a E o (I2/I — ) = 0,53 B ?
CuF2 плохо растворим в воде, хлорид и бромид – хорошо. Окраска раствора дихлорида меди зависит от концентрации: концентрированный коричневый раствор при разбавлении становится зеленой, а затем голубой. Это связано с равновесием
CuX2 дают комплексы с галогенид-ионами: Na[CuCl3], K2[CuF4] и др., а также с аминами и др..
? почему нельзя получить безводный дихлорид меди нагреванием дигидрата? Как в таком случае действовать, чтобы получить CuCl2?
Из галогенидов серебра (II) известен только дифторид – серо-стальные (при наличии примесей – темно-коричневые) кристаллы. Это очень сильный окислитель и фторирующий агент:
AgF2 AgF + [F]; (генерация атомарного фтора)
Получают дифторид серебра фторированием металла или AgF.
Галогениды золота (II) достоверно не описаны.
в) Степень окисления +3.
CuF3, AgF3 – очень неустойчивы, очень сильные окислители: CuF3 разлагается при низких температурах (имеются сомнения в его существовании), AgF3 – около 150 о С.
Для золота в степени окисления +3 известны все 4 галогенида. Трифторид золота полностью гидролизуется водой; в неводных средах образует ацидокомплексы:
Получают AuF3 растворением металла в жидком трифториде брома с последующим нагреванием продукта в вакууме:
Хлорид и бромид золота (III) получают синтезом из элементов (хлорид — при слабом нагревании, бромид – при комнатной температуре), а также термическим разложением кислот H[AuX4]nH2O. Эти галогениды также проявляют кислотность по Льюису:
AuI3 малорастворим в воде и малоустойчив:
УЭ-2. Другие бинарные соединения.
Известны сульфиды: Cu2S, CuS, Ag2S, Au2S, Au2S3 (оба последних малоустойчивы).
Первые 3 сульфида встречаются в природе и служат сырьем для получения меди и серебра (минералы халькозин, ковеллин, аргентит).
Сульфиды Cu и Ag нерастворимы в воде, окисляются при нагревании на воздухе и при действии кислот-окислителей.
Сульфиды золота при нагревании распадаются на простые вещества.
1) синтезом из элементов;
2) взаимодействием H2S с солями и комплексами Э (Au2S3 – в эфирном растворе).
Известны также селениды и теллуриды Э: Cu2Se, Cu2Te; Ag2Se, Ag2Te; Au2Se3, AuTe2 (минерал калаверит). Селенид и теллурид меди являются компонентами анодного шлама при электролитической очистке меди; это сырье для производства селена и теллура.
б) Нитриды, фосфиды.
Cu I 3N – вещество зеленого цвета; разлагается при 300 о С.
Синтезируют нитрид меди (I) при нагревании CuF2 или CuO в токе NH3.
Ag I 3N – черно-коричневый порошок; взрывоопасен даже во влажном состоянии.
Осаждается при стоянии раствора аммиаката Ag I в щелочной среде.
Cu3P, Au2P3 – обладают металлической проводимостью;
Карбиды Э2С2 представляют собой нерастворимые в воде порошки (Cu2C2 – коричнево-красный, Ag2C2 – белый, Au2C2 – желтый), взрывоопасные в сухом состоянии. Эти вещества являются ацетиленидами – их можно рассматривать как соли ацетилена C2H2. Их получают действием ацетилена на растворы комплексов Э(I), поскольку простые вещества не взаимодействуют с углеродом:
Описан только гидрид меди (I) CuH – красно-коричневый порошок, разлагающийся около 60 о С (иногда – со взрывом); неустойчив, обладает восстановительными свойствами.
Синтез этого вещества проводят двумя методами:
УЭ-3. Комплексные соединения.
а) Степень окисления +1.
Ионы Э + обладают электронной конфигурацией nd 10 (d-подуровень целиком заполнен), поэтому:
1) геометрия комплексов находится в соответствии с ОЭПВО (ЭL2 – линейные, ЭL3 – плоские треугольные, ЭL4 — тетраэдрические);
2) характерны низкие КЧ (2-4);
3) отсутствует -акцепторный вклад в связь Э-L, поэтому прочность связи обычно невысока;
4) как правило, комплексы лишены окраски и (всегда) диамагнитны.
Хотя nd-подуровень и является заполненным, он все же придает ионам Э + высокую поляризуемость, вследствие чего рассматриваемые ионы являются мягкими кислотами Льюиса и стремятся образовывать КС с мягкими (поляризуемыми) лигандами; связь в комплексах обычно близка к ковалентной.
Из наиболее известных КС элементов подгруппы меди в степени окисления +1 можно упомянуть: аммиакаты [Э(NH3)2] + , галогенидные [ЭHal2] — , тиосульфатные [Э(S2O3)2] 3- и цианидные [Э(CN)2] — , [Э(CN)3] 2- и [Э(CN)4] 3- КС, а также аналогичные роданидные комплексы.
Комплексы Cu I , как правило, легко окисляются (достаточно кислорода воздуха, см. выше).
Эти же комплексы легко и обратимо поглощают CO:
Эту реакцию используют для выделения CO из смеси газов, также этот процесс нашел применение в производстве аммиака: азотоводородную смесь пропускали через раствор аммиаката меди (I), чтобы избавиться от каталитического яда CO.
Галогенидные комплексы серебра (I) [AgX2] — (X = Cl, Br, I) образуются при добавлении избытка галогенид-ионов к раствору соли Ag + , поэтому при осаждении галогенида серебра (в аналитической химии) нельзя применять избыток осадителя!
Тиосульфатный комплекс Ag(I) образуется в процессе фиксажа черно-белых фотографий; аналогичный комплекс золота – отечественный медицинский препарат санокризин.
б) Степень окисления +2.
Как указывалось выше, соединения Ag II проявляют очень сильные окислительные свойства, а соединения золота (II) практически не существуют из-за диспропорционирования. В противоположность этому, для Cu наиболее характерна именно степень окисления +2.
Медь (II) образует, помимо прочих, октаэдрические комплексы [CuL6], но важно отметить, что октаэдр [CuL6] не является правильным (длины связей Cu-L различны), даже если все 6 лигандов одинаковы. Это – проявление эффекта Яна-Теллера (см. выше).
Если две апикальные связи Cu-L в вытянутом октаэдре [CuL6] растянутся еще больше, то мы получим плоскоквадратный комплекс [CuL4]. Это подтверждается существованием ряда квадратных комплексов [CuL4], как правило, образованных лигандами сильного поля:
[Cu(CN)4] 2- , [Cu(acac)2] (ацетилацетонат), комплексы с макроциклическими лигандами – порфиринами, фталоцианинами и др.
Наоборот, тетраэдрические КС [CuL4], во-первых, гораздо более редки, а, во-вторых, образуются только с объемистыми лигандами (Cl — , Br — ). Связь металл-лиганд в этих комплексах не отличается устойчивостью.
Из комплексов меди (II) наиболее известен аммиакат:
В водном растворе этот комплексный катион существует в виде [Cu(NH3)4(H2O)2] 2+ , но так как 2 молекулы воды значительно удалены от иона Cu 2+ , они легко отделяются уже при кристаллизации КС. Этот комплекс устойчив в щелочной среде, но разрушается при действии H2S.
? Приведите уравнения указанных реакций.
В то же время, например, тетрацианокупрат (II) устойчив и к действию сероводорода, поскольку цианидные КС меди (и большинства других металлов) отличаются высокой устойчивостью.
Из комплексов Ag II известны только фторидные КС (K2[AgF4], Ba[AgF4]), а также КС с гетероциклическими аминами (пиридином, фенантролином). Все они являются сильными окислителями (не уступают Bi V ).
Для Au II комплексные соединения не описаны.
в) Степень окисления +3.
Для меди и серебра (III) известны отдельные примеры КС, но все они проявляют очень сильные окислительные свойства и малоустойчивы:
Для золота (III) известно много КС; они более устойчивы, чем простые соединения золота. Это связано с устойчивостью конфигурации d 8 и склонностью золота к образованию ковалентных связей.
Комплексы золота (III) имеют КЧ 4 и плоскоквадратную геометрию. Самым известным КС является тетрахлорозолотая (золотохлористоводородная) кислота H[AuCl4]4H2O – светло-желтые кристаллы, tразл = 120 о С. Известны ее соли, соль Cs плохо растворима. Известны аналогичные тетрагалогеноаураты для F, Br, I; производные фтора нацело гидролизуются в водной среде. Описаны также нитратные M I [Au(NO3)4], сульфатные M I [Au(SO4)2] и ацетатные M I [Au(CH3COO)4] комплексы. Очень устойчивы цианидные и роданидные КС:
Известно много комплексов Au III с органическими лигандами: аминами, тиоэфирами R2S, фосфинами R3P и др.
Смешанно-лигандный комплекс [(CH3)2Au(acac)] отличается высокой летучестью в вакууме при слабом нагревании; его используют в микроэлектронике для создания тонких пленок металла (разложением на нагретых до 140 о С поверхностях).
Применение КС элементов группы меди.
? Опишите основные области применения КС элементов IB подгруппы.
? Заполните следующую таблицу (в графе «Название» указывайте систематическое название соединения).
Источник: studfile.net
главная > справочник > химическая энциклопедия:
Гемифторид Ag 2 F при нагр. выше 90°С и при растворении в воде разлагается с образованием AgF и Ag; диамагнитен; м. б. получен УФ облучением AgF. Фторид AgF гигроскопичен; хорошо раств. в воде (172 г в 100 г при 20 °С); в системе AgF-H 2 O температура эвтектики —14,2 °С (37,5% по массе AgF); до 18,6°С в равновесии с раствором (62,9% по массе AgF) находится тетрагидрат AgF·4H 2 O ( 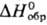 —1387,8 кДж/моль,
—1387,8 кДж/моль,  -1145,6 кДж/моль), до 39,5 °С (68,95% AgF)-дигидрат AgF·2H 2 O (
-1145,6 кДж/моль), до 39,5 °С (68,95% AgF)-дигидрат AgF·2H 2 O ( 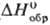 -801,6 кДж/моль,
-801,6 кДж/моль,  — 669,9 кДж/моль), выше 39,5 °С- безводная соль. Дифторид AgF 2 разлагается водой с образованием AgF, HF, О 2 и примеси О 3 .
— 669,9 кДж/моль), выше 39,5 °С- безводная соль. Дифторид AgF 2 разлагается водой с образованием AgF, HF, О 2 и примеси О 3 .

-10 ), раств. в конц. HNО 3 .
Бромид (минерал бромаргирит) AgBr до 259 °С существует в кубич. кристаллич. модификации, выше 259 °С- в ромбич.; не раств. в воде (произведение растворимости 5,4 x x 10 -13 ).
а = 0,4596 нм, с = 0,7500 нм, z = 2, пространств. группа Р 6 3 тс ) , выше 147 °С-кубич. g-модификация; не раств. в воде (произведение растворимости 8,5·10 -17 ), раств. в этаноле.
С. г. раств. в избытке соответствующих галогеноводород-ных кислот с образованием галогенидных комплексов, они также раств. в растворах цианидов и тиосульфатов щелочных металлов и водном аммиаке с образованием комплексных ионов Ag. С. г. восстанавливаются до Ag неорг. (Pb, Zn, Mg, Н 2 ) и орг. (гидразин, формальдегид. гидрохинон и т.п.) восстановителями. Под действием света разлагаются с выделением Ag°; светочувствительность AgF больше, чем у AgCl.
С. г. получают взаимод. Ag с галогенами в присутствии воды, а также обработкой Ag конц. водными растворами галогеново-дородных кислот и обменным взаимод. между растворимой соль. Ag и соответствующим галогенидом металла.
Для регенерации Ag из разл. отходов используется сплавление С. г. с карбонатами щелочных металлов. С. г. (AgCl, AgBr, AgI) используют для получения светочувствит. эмульсий в произ-ве кино- и фотоматериалов. Из AgCl изготовляют элементы оптики для ИК спектрометров, детекторы космич. излучений. AgBr-катализатор при получении некоторых карбоновых кислот.
AgF, AgI и двойные иодиды щелочных металлов и Ag обладают высокой ионной проводимостью в твердом состоянии и применяются для изготовления твердых электролитов и датчиков. AgF используют также как компонент люминофоров и фторирующий агент в орг. синтезе, AgI-при гальванич. серебрении, для образования искуссю дождя и снега из грозовых туч. П. М. Чукуров.
Источник: www.chemport.ru