Как видите, потенциал хлоридного электрода определяется активностью хлорид-ионов в растворе. Обычно используется насыщенный раствор KC1. Потенциал электрода второго типа обычно зависит от анионной активности плохо растворимого соединения, которое является частью электрода.
Каломельные электроды состоят из растворов металлической ртути, каломеля и KC1. Возможность также зависит от активности хлоридных ионов. ^ Hg? VHg2ci2 == ^ HgI + / HB, ci, -In ^ ci » Где ^ ^ Hg2VHg9ci? = + Потенциалы хлорида серебра, каломели и многих других электродов сравнения были изучены при различных концентрационных и температурных условиях, и значения для стандартных водородных электродов хорошо известны.
Однако при выполнении таких измерений, если вас интересует потенциал индикаторного электрода, а также ЭДС, это значение необходимо. Если не указано иное, потенциал индикаторного электрода обычно пересчитывается и относится к стандартному водородному электроду.
Конечно, это значение больше не зависит от выбранного электрода сравнения. Людмила Фирмаль





















































Лекция 7. Стандартный электродный потенциал и формальный потенциал
Лекция 5 Электроды сравнения и измерение электродных потенциалов
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Источник: lfirmal.com
Хлорсеребряный электрод.
Уравнение (7.4) описывает поведение хлорсеребряного электрода.

(7.г)

(7.5)
т.е. такой электрод обладает постоянным потенциалом при постоянной концентрации ионов хлора. Схема хлорсеребряного электрода представлена на рис. 7.1.
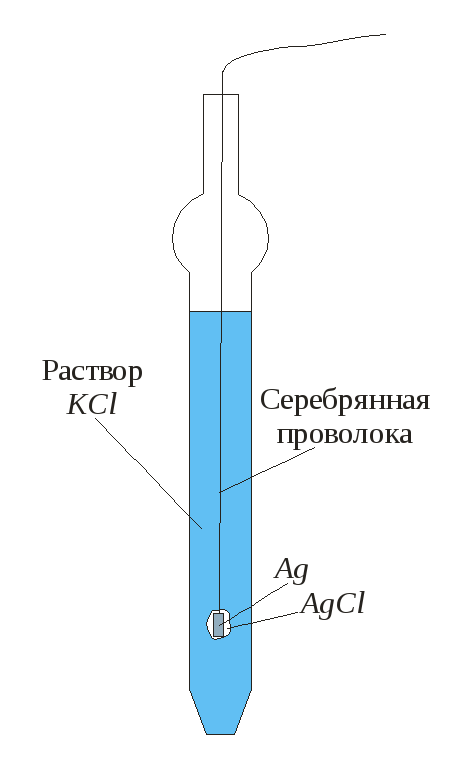
Рис. 7.1 Хлорсеребряный электрод.
Такой электрод может быть использован в качестве электрода сравнения. В качестве стандартных электродов сравнения используются и другие электроды. Например, каломельный.


(7.6)
Стандартные электроды сравнения (хлорсеребряный, каломельный и другие), часто используются вместо водородного, потому, что их применение гораздо более удобно.
Окислительно – восстановительные (redox) системы.
В отличие от электродов первого и второго рода, где металл и раствор обмениваются катионами, в окислительно–восстановительных электродах между этими фазами осуществляется только электронный обмен, а в качестве металлической фазы используется какой – то благородный металл (золото, платина), но чаще именно платина. Применим уравнение (7.1) к реакции (7.д).

(7.д)
В итоге получаем:
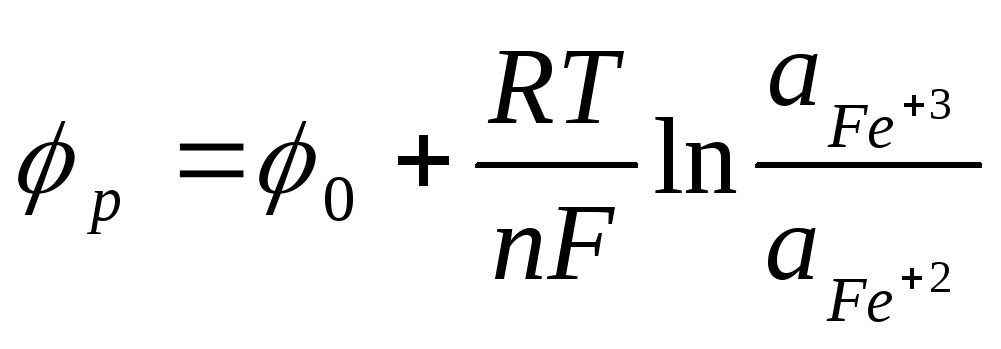

-это стандартный окислительно–восстановительный потенциал redox реакций.

(7.е)

(7.7)
Стандартные потенциалы некоторых окислительно-восстановительных – систем.

,B
PbSO4+2H2O  PbO2+
PbO2+ + 4H + +2
+ 4H + +2

Mn +2 /
Mn +2 +4H2O 
 +8H + +5
+8H + +5

HNO2/
HNO2+H2O 
 +3H + +2
+3H + +2
Fe +2 /Fe +3
Fe +2  Fe +3 +
Fe +3 +
Cu + /Cu +2
Cu +  Cu +2 +
Cu +2 +
H2 2H + +2
2H + +2
Cr +2 /Cr +3
Cr +2  Cr +3 +
Cr +3 +
Fe(OH)2 +OH —  Fe(OH)3+
Fe(OH)3+
Водородный электрод.
Водородный электрод является разновидностью окислительно-восстановительного электрода и представляет собой платиновую пластину, покрытую платиновой чернью, помещённую в раствор серной кислоты (рис. 7.2). К этой пластине осуществляется подача газообразного водорода при температуре 25C, и давлении водорода в 1 атмосферу. Молекулы водорода адсорбируются на платине, распадаясь при этом на атомы. На поверхности пластины устанавливается следующее равновесие:
2H + + 2
 H2 (7.ж)
H2 (7.ж)
Потенциал этого электрода может быть выражен уравнением:

(7.8)

Рис. 7.2 Схема водородного электрода
Хингидронный электрод.

(7.з) Это окислительно-восстановительный процесс перехода гидрохинона в хинон.

(7.и)
К реакциям (7.и) и (7.з) применим уравнение Нернста.
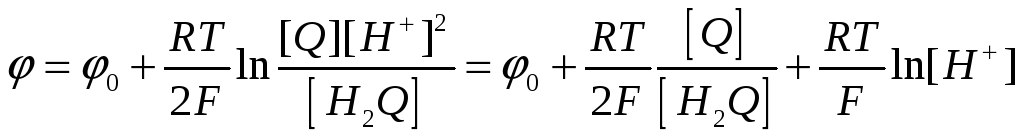
(7.8)

Из (7.8) при мы получаем:

(7.9)
Т.е. используя хингидронный электрод и измеряя его потенциал, мы фактически определяем pH раствора.
Источник: studfile.net
Хлорсеребряный электрод сравнения
Хлорсеребряный электрод (рис. 27) состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в раствора KCl определенной концентрации (обычно насыщенный раствор KCl ) и солевого мостика, соединяющего этот раствор с исследуемым раствором. Электрохимическая цепь хлорсеребряного электрода записывается так: Ag | AgCl , KCl (нас).
В хлорсеребряном электроде на межфазной границе протекает следующая реакция:



Так как активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов 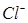 в растворе. Если активность ионов
в растворе. Если активность ионов 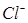 поддерживать постоянной, то потенциал хлорсеребряного электрода будет постоянной величиной. Проще всего поддерживать постоянной активность ионов хлора в растворе, используя насыщенный раствор KCl, в котором а (
поддерживать постоянной, то потенциал хлорсеребряного электрода будет постоянной величиной. Проще всего поддерживать постоянной активность ионов хлора в растворе, используя насыщенный раствор KCl, в котором а ( 
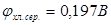 .
.
Рис. 27 Хлорсеребряный электрод сравнения
В гальваническом элементе хлорсеребряный электрод в зависимости от потенциала второго электрода может быть как анодом, так и катодом. В случае анода протекают реакции окисления серебра и взаимодействия его катиона с анионом хлора с образованием осадка AgCl:




Анод

(окисление)

В случае катода в системе происходит растворение осадка AgCl и восстановление катионов :




Анод

(восстановление)
Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
ИОНО- И МОЛЕКУЛЯРНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ ОПРЕДЕЛЕНИЯ
Для измерения концентрации активных ионов: 
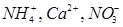 и других, а также различных веществ используют электроды определения, которые называют также индикаторными электродами. Потенциалы этих электродов зависят в основном от концентрации определяемого иона или вещества. Электродами определения прежде всего являются ионоселективные электроды, действие которых основано на возникновении мембранного потенциала на мембране с селективной чувствительностью к данному иону. Подобная мембрана способна адсорбировать или пропускать только определенный ион.
и других, а также различных веществ используют электроды определения, которые называют также индикаторными электродами. Потенциалы этих электродов зависят в основном от концентрации определяемого иона или вещества. Электродами определения прежде всего являются ионоселективные электроды, действие которых основано на возникновении мембранного потенциала на мембране с селективной чувствительностью к данному иону. Подобная мембрана способна адсорбировать или пропускать только определенный ион.

Все ионоселективные электроды в зависимости от агрегатного состояния мембран подразделяются на электроды с твердыми и жидкими мембранами. Наиболее широко используемым ионоселективным электродом определения с твердой мембраной является стеклянный электрод.
Стеклянный электрод представляет собой трубку, заканчивающуюся тонкостенной стеклянной мембраной в виде шарика, чувствительной к определенному виду ионов. Внутри находится раствор, содержащий данный вид ионов, в который опущен внутренний электрод сравнения, соединяемый с внешней цепью.
Чаще всего используется стеклянный электрод, чувствительный к ионам и поэтому позволяющий определить рН раствора. В этом случае внутренним раствором является 0,1 М раствор HCl, а стеклянную мембрану (шарик) изготавливают из специального литийбарийсиликатного стекла (Рис. 28). Обозначают: Ag | AgCl | HCl.
Рис. 28 Стеклянный электрод для измерения рН
Чтобы повысить чувствительность стеклянной мембраны к ионам  , стеклянный электрод после хранения необходимо вымочить в разбавленном растворе HCl и далее сохранять в дистиллированной воде. При вымачивании стеклянной мембраны в кислоте поверхность стекла гидратируется, ионы щелочного металла в стекле обмениваются на ионы водорода
, стеклянный электрод после хранения необходимо вымочить в разбавленном растворе HCl и далее сохранять в дистиллированной воде. При вымачивании стеклянной мембраны в кислоте поверхность стекла гидратируется, ионы щелочного металла в стекле обмениваются на ионы водорода  , находящиеся в растворе:
, находящиеся в растворе:



В результате на каждой границе стекло-раствор возникает свой двойной электрический слой, характеризующийся потенциалом, зависящим от активности ионов  . Между внутренней и наружной поверхностями мембраны появляется разность потенциалов, которая зависит в основном от активности ионов
. Между внутренней и наружной поверхностями мембраны появляется разность потенциалов, которая зависит в основном от активности ионов 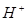 в исследуемом растворе, так как внутренний раствор имеет постоянную активность ионов
в исследуемом растворе, так как внутренний раствор имеет постоянную активность ионов 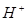 . Для измерения этой разности потенциалов необходимо составить гальваническую систему из стеклянного электрода, содержащего обычно внутренний хлорсеребряный электрод, и внешнего электрода сравнения (см. рис. 29):
. Для измерения этой разности потенциалов необходимо составить гальваническую систему из стеклянного электрода, содержащего обычно внутренний хлорсеребряный электрод, и внешнего электрода сравнения (см. рис. 29):



 ЭДС =
ЭДС = 
 |
 |
Стеклянный электрод Внешний электрод
 |
 |
 |
 |
 |
 |
Внутренний Внутренний Стеклянная Исследуемый KCl ( p ) AgCl , Ag
электрод раствор мембрана раствор насыщ.
сравнения 0,1 М HCl рН = ?
Ag, AgCl a(H + ) = const
Рис. 29 Установка для потенциометрического титрования
1 – стакан для титрования; 2 – индикаторный электрод; 3 – электрод сравнения;
4 – бюретка; 5 – мешатель; 6 – исследуемый раствор; 7 – магнитная мешалка;
8 – рН-метр-милливольтметр
Потенциал стеклянного электрода является функцией рН исследуемого раствора, и ЭДС гальванической цепи из стеклянного электрода и электрода сравнения тоже будет функцией рН исследуемого раствора.
Лекция 6
Дата добавления: 2018-09-22 ; просмотров: 2656 ; Мы поможем в написании вашей работы!
Источник: studopedia.net