Текст научной статьи на тему «ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ СЕРЕБРА В ЭВТЕКТИЧЕСКОМ РАСПЛАВЕ LICL-4KCL-2CSCL»
УДК 546.571:546.34 ’32 ‘36131:544.653
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ СЕРЕБРА В ЭВТЕКТИЧЕСКОМ РАСПЛАВЕ LiCl-4KCl-2CsCl
Определены значения условного стандартного электродного потенциала серебра в расплаве эвтектической смеси хлоридов лития, калия и цезия в интервале температур 573-1073 К.
Ключевые слова: хлоридные расплавы, равновесные потенциалы, условный стандартный потенциал, серебро, хлоридсеребряный электрод сравнения, хлорный электрод сравнения.
Введение. Расплавленные смеси хлоридов щелочных металлов являются рабочими средами для электролитического получения и рафинирования ряда редких металлов, нанесения гальванических покрытий, пироэлектрохимической переработки облученного ядерного топлива. Для разработки и практической реализации технологических процессов необходима детальная информация об электрохимических свойствах и поведении металлов в расплавленных хлоридных электролитах. При проведении электрохимических исследований в качестве нулевого потенциала принят потенциал хлорного электрода. Однако применение хлорного электрода сравнения в ряде случаев может быть осложнено некоторыми факторами, в частности, нестабильностью работы и большими геометрическими размерами.
ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.
В качестве альтернативы хлорному электроду в расплавленных солях нашли применение металлические электроды (свинцовый, платиновый, серебряный), отличающиеся компактным исполнением и более высокой стабильностью работы. Серебряный электрод широко используется при исследовании хлоридных расплавов, и описание его устройства можно найти во многих работах [1-9]. Тройная эвтектическая смесь хлоридов лития, калия и цезия имеет одну из самых низких температур плавления (536 К) среди хлоридов щелочных металлов и позволяет проводить электрохимические и спектроэлектрохимические исследования в широком температурном диапазоне. В литературе, однако, отсутствуют данные об электродном потенциале серебра в данном электролите. Цель настоящей работы — определение температурной зависимости условного стандартного электродного потенциала серебра в расплаве LiCl— KCl—CsCl в интервале 573—1073 К.
Экспериментальная часть. Эксперименты проводили в расплавах на основе тройной эвтектической смеси LiCl—KCl—CsCl (57.5—16.5—26 мол. %). Методика подготовки исходных солей описана ранее [10]. Электролиты, содержащие хлорид серебра, готовили растворением необходимого количества AgCl (Vickers Laboratories Ltd.) в расплаве соли-растворителя. Концентрацию серебра в расплаве варьировали от 0.18 до 3.54 мас. %.
ЭДС гальванического элемента
Ag|(LiCl—KCl—CsCl) + AgCl||(LiCl—KC1—CsCl), Cl2, графит (1)
измеряли с использованием потенциостата-гальваностата AUTOLAB PGSTAT 12/30/302 в режиме нулевого тока. Электролит находился в тигле из оксида бериллия, помещен-
Рис. 1. Равновесные электродные потенциалы серебра в расплаве LiCl-KCl-CsCl. Концентрация серебра, мас. %: 1 — 0.18, 2 — 1.00, 3 — 1.96, 4 — 3.54.
Основы электрохимии
£*g(I)/Ag = (-1.088 + 2.86 • 10-4 • T) ± 0.003, В, (2)
A^AgCl = (-105.01 + 2.76 • 10-2 • T) ± 0.28, кДж/моль. (3)
Значения условных стандартных потенциалов, полученные в настоящей работе, хорошо согласуются с литературными данными для хлоридных расплавов иного катион-ного состава (рис. 3). Наблюдается общее закономерное смещение потенциала в отрицательную область с увеличением радиуса катиона соли-растворителя. Принимая во
Рис. 2. Условные стандартные электродные потенциалы серебра в расплаве ЦС1—КС1—С$С1 относительно
хлорного электрода сравнения. Значения EAg(I)|Ag рассчитаны на основании равновесных электродных потенциалов, измеренных в расплавах с различной концентрацией ионов Ag(I) (указана на графике в мас. % для каждого набора данных).
Рис. 3. Температурная зависимость EAg(I)/Ag в расплавах хлоридов щелочных металлов относительно
Cl2/Cl—: LiCl—KCl [11] — 1, LiCl [13] — 2, LiCl—KCl [14] — 3, LiCl—KCl—CsCl (наст. работа) — 4, NaCl—KCl [15, 16] — 5, NaCl—CsCl [17] — 6.
внимание обычно наблюдаемую линейную зависимость величин условных стандартных электродных потенциалов от обратного радиуса катиона соли-растворителя, можно заключить, что значения электродных потенциалов серебра для расплавов LiCl—KCl и LiCl, приведенные в работах [12, 13], смещены в отрицательную область, в
то время как значения, приводимые в [11] для расплава LiCl-KCl, более положительные, чем можно было бы ожидать.
Следует также отметить, что, помимо указанных выше, в литературе имеется ряд работ, посвященных исследованию свойств (в том числе электрохимических) серебра в расплавах, как на основе индивидуальных хлоридов щелочных металлов [18-22], так и их смесей [23]. Однако, концентрация серебра в исследованных системах достаточно высока (10-43 мол. % [19-21], 14 мол. % [18], 4-31 мол. % [22]). В подобных расплавах коэффициенты активности ионов Ag(I) уже нельзя считать неизменными, что не позволяет провести расчет величин условных стандартных потенциалов на основе приводимых результатов электрохимических измерений.
Выводы. В настоящей работе впервые измерены электродные потенциалы серебра в расплавах на основе тройной эвтектической смеси LiCl-KCl-CsCl и получена температурная зависимость условного стандартного электродного потенциала серебра в интервале 573-1073 К. Представленные данные позволяют использовать серебряный электрод в качестве электрода сравнения при поведении электрохимических измерений в расплаве эвтектической смеси хлоридов лития, калия и цезия.
1. Bonnemay M., Pineaux R. A reference electrode of silver chloride useful in molten salts. — Compt. Rend., 1955, 240, p. 1774-1776.
2. Bonnemay M., Pineaux R. The silver/silver chloride electrode in molten salts. — In: Proc. Int. Comm. Electrochem. Thermodynamics and Kinetics, 8-th Meeting. — Madrid, 1956, 1622 September. — London: Butterworths, 1958, p. 190-194.
3. Rey M., Danner G., Abraham M. A reference electrode utilizable in fused media between 96 and 1300°. — Compt. Rend., 1959, 248, p. 2868-2870.
4. Rey M., Danner G. Reference electrode working up to 1300°. — Silicates Ind., 1960, 25, p. 19-22.
5. Rey M., Danner G., Abraham M. Electrodes de reference pour hautes temperatures. — Electrochim. Acta, 1961, 4, p. 274-287.
6. Labrie R.J., Lamb V. A. A porcelain reference electrode conductive to sodium ions for use in molten salt systems. — J. Electrochem. Soc., 1959, 106, p. 895-899.
7. Littlewood R. A reference electrode for electrochemical studies in fused alkali chlorides at high temperatures. — Electrochim. Acta, 1961, 3, p. 270-278.
8. Winand R. The mechanism of operation of silver-wire electrodes used in mixtures of molten chlorides at elevated temperature. — Silicates Ind., 1961, 26, p. 339-340.
9. Petit M. Diffusion of silver through Pythagoras porcelain. — Compt. Rend., 1964, 258, p. 6143-6146.
10. Волкович В.А., Данилов Д.А., Васин Б.Д., Хохряков А.А. Спектроскопическое исследование рения в расплавах галогенидов щелочных металлов. — Расплавы, 2006, № 4, с. 21-28.
11. Shirai O., Nagai T. , Uehara A., Yamana H. Electrochemical properties of the Ag+|Ag and other reference electrodes in the LiCl-KCl eutectic melts. — J. Alloys Comp., 2008, 456, p. 498-502.
12. Yang L., Hudson R.G. Some investigations of the Ag/AgCl in LiCl-KCl eutectic reference electrode — J. Electrochem. Soc., 1959, 106, № 11, p. 986-990.
13. Panish M.B., Newton R.F., Grimes W.R., Blankenship F.F. Thermodynamic properties of molten and solid solutions of silver chloride and lithium chloride. — J. Phys. Chem., 1959, 63, p. 668-671.
14. Laitinen H.A., Lui C.H. An electromotive force series in molten lithium chloride-potassium chloride eutectic. — J. Amer. Chem. Soc., 1958, 80, № 5, p. 1015-1020.
15. Flengas S.N., Ingraham T. R. Electromotive force series of metal in fused salts and activities of metal chlorides in 1 : 1 molar NaCl-KCl solutions. — J. Electrochem. Soc., 1959, 106, № 8, p. 714-721.
16. Combes R., Vedel J., Tremillon B. Standard potential determinations in molten NaCl-KCl. — J. Electroanal. Chem., 1970, 27, p. 174-177.
17. Васин Б.Д., Распопин С.П., Иванов В. А. Растворение серебра в урансо-держащих хлоридных расплавах. — В кн.: VI Кольский семинар по электрохимии редких и цветных металлов. Апатиты, Кольский научный центр.: Тезисы докл. — Апатиты: КНЦ, 1989, с. 88.
18. Pelton A.D., Flengas S.N. Thermodynamics of molten silver chloride-alkali chloride solutions by electromotiv
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Источник: naukarus.com
Стандартные электродные потенциалы металлов при 25 °С (Таблица)
Справочная таблица электродные потенциалы металлов по общей и неорганической химии содержит: электрод, электродная реакция и стандартный потенциал. Таблица содержит справочный материал, необходимый для решения задач по общей и неорганической химии. Предназначено для школьников и студентов.
Потенциалы Е°, В
Поделитесь ссылкой с друзьями:
Похожие таблицы
- Температура кипения металлов (Таблица)
- Цветные металлы их применение и добыча (Таблица)
- Плотность металлов и сплавов (Таблица)
- Удельное сопротивление металлов, электролитов и веществ (Таблица)
- Химические свойства металлов — активные, средней активности, малоактивные (Таблица)
- Температурный коэффициент линейного расширения металлов, твердых веществ, жидкостей (Таблица)
- Стандартные потенциалы окислительно- восстановительных пар (Таблица)
- Электрохимический ряд напряжения металлов (Таблица)
- Коэффициент теплопроводности металлов (Таблица)
- Термоэлектронная эмиссия металлов определение и значения (Таблица)
| Подписываемся на обновления! | |||||
Информация, размещенная на сайте, предоставлена в целях ознакомления. Владельцы сайта infotables.ru не несут ответственности за риски, связанные с использованием информации, полученной с этого cайта.
Источник: infotables.ru
Стандартные электродные потенциалы металлов
В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым переодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые же металлы, такие, как Cu, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот — водород сам способен вытеснять металлы из солей ртути и серебра.
Итогом трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда — «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала.
Что же такое электродный потенциал? Как он возникает?
Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (и тогда потенциал положителен) или которую можно получить (и тогда потенциал отрицателен) при переносе единицы электричества из бесконечности в данную точку.
Согласно современным представлениям, в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением.
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость Me z + + mH2O? [Me(H2O)m] z+ , а электроны останутся на пластинке металла, в результате чего металл зарядиться отрицательно.
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так (рис.1):
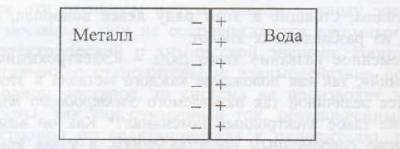
Рис.1. двойной электрический слой на границе металл–вода
Таким образом, на границе соприкосновения жидкости с металлом электрический потенциал? резко изменяется и наблюдается скачок (или разность) потенциала ??, который принято называть электродным потенциалом.
. В большинстве современной химической литературы скачки потенциалов обозначаются просто ?.
Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, следовательно, б?льшим будет отрицательный заряд металла, что, в свою очередь, обусловит б?льшую разность потенциалов на границе металл—жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
На рис. 2. представлена схема возникновения двойного электрического слоя в случае цинковой и медной пластинок, погруженных в растворы их солей.
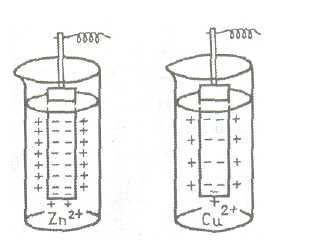
Рис.2. Схема возникновения электродного потенциала
Видно, что величина электродного потенциала определяется прежде всего природойметалла. Кроме того она зависит от температуры, концентрации раствора и других факторов. Поэтому для сравнения электродных потенциалов необходимо выбрать некоторые стандартные условия. Обычно сравнение производят при 25°С, давлении 101,3 кПа и в растворе с концентрацией одноименного иона, равной единице (1 моль/л).
Таким образом, стандартным электродным потенциалом называется электродный потенциал при концентрации иона металла 1 моль/л.
Абсолютное значение электродного потенциала измерить невозможно (поскольку введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов). Вместе с тем не представляет труда измерение величины относительного электродного потенциала.
Относительные электродные потенциалы металлов измеряют относительно стандартного водородного электрода, потенциал которого произвольно принят за нуль.
Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в стандартном водородном электроде используют инертный металл (например, Pt).
Конструктивно водородный электрод (рис.3) состоит из платиновой пластинки, покрытой слоем мелкозернистой платины — платиновой чернью, частично погруженной в раствор кислоты с концентрацией ионов водорода, равной 1 моль/л. Обычно берут раствор нелетучей кислоты — серной H2SO4 или хлорной HClO4. К пластинке подают чистый газообразный водород под постоянным давлением 101,3 кПа.
Возникновение потенциала на стандартном водородном электроде можно представить следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние, поэтому в поверхностном слое платины устанавливается равновесие Н2? 2Н, а на границе платины и раствора серной кислоты — равновесие Н? Н + + е.
Суммарный процесс выражается уравнением:
Таким образом, водородный электрод можно обозначить как Н2/Н + , Pt, где вертикальная черта означает поверхность раздела фаз.
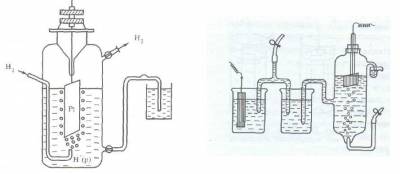
Рис. 3. Схема водородного электрода или так
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом (рис.3), то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродныхпотенциаловводородногоэлектродаи изучаемогометалла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента:
ЭДС = ?? 1 – ?? 2 или ЭДС = ??к – ?? А
В замкнутом гальваническом элементе, т.е. при измеряемом значении силы тока в элементе (т.е. при соединении платины с некоторым металлом металлическим проводником) разность потенциалов катода и анода называют напряжением:
Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента, т.е. U < ЭДС.
Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока (в физике ЭДС = I·R + I·rвнутр .., где rвнутр– внутреннее сопротивление электродов. При I ~ 0 произведение I·rвнутр.. = 0, но выражение I·R хоть и очень мало, но все-таки оно есть и равно ЭДС).
Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю. Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое сопротивление (высокоомным вольтметром). Вследствие высокого сопротивления вольтметра мал ток, протекающий через элемент, поэтому не велика разница между ЭДС и напряжением элемента.
Измеренная ЭДС цепи, составленной из стандартного водородного электрода и стандартного металлического электрода является электродным потенциалом последнего.
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, то получим ряд напряжений металлов:
?? 0 , В K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
(или просто ? 0 ) –2,92 –2,38 0,0 0,8 1,2
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньшей алгебраической величиной ? 0 обладает металл, тем он химически активнее, т.е. тем больше его восстановительная способность.
2. Чем дальше расположены друг от друга в ряду напряжений два металла, тем б?льшую электродвижущую силу будет иметь построенный из них гальванический элемент, причем катодом всегда будет являться тот электрод, потенциал которого больше.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru