Системы, в которых одна составная часть распределена в мелкораздробленном состоянии в среде другой, называются дисперсными.
Составная часть, распределённая в виде отдельных мелких твёрдых частиц, капелек жидкости или пузырьков газа, составляет дисперсную фазу,
а другая часть, окружающая частицы дисперсной фазы, называется дисперсионной средой.
Дымы и туманы в воздухе, взвеси глины и песка в воде, коллоидные системы, содержащие частицы, более крупные, чем обычные молекулы, и, наконец, истинные растворы — молекулярные или ионные – всё это различные дисперсные системы.
В зависимости от размера частиц дисперсной фазы системы делятся на
а) грубодисперсные (взвеси) — диаметр частиц больше 10 –5 см;
б) коллоидно-дисперсные (золи) – 10 –5 – 10 –7 см;
в) истинные растворы – размер частиц меньше 10 –7 см.
Взвеси могут существовать в виде суспензий или эмульсий. В первом случае твёрдое вещество взвешено в жидкости (мел в воде), во втором – жидкое вещество в жидкости (жир в воде).
ЗОЛОТО ИЗ ЗОЛЫ……..МИКРОСХЕМ!
Частицы грубодисперсных систем различимы визуально и, если они распределены в жидкости или газе, то постепенно оседают или всплывают.
В коллоидных системах дисперсная фаза нерастворима в дисперсионной среде и отделена от неё поверхностью раздела; таким образом, коллоидные системы являются гетерогенными системами в отличие от истинных растворов, которые являются гомогенными, однородными. Если дисперсионная среда – жидкость, а дисперсная фаза – твёрдое вещество, коллоидная система называется золем; если дисперсная фаза – жидкость, система называется эмульсией.
Высокоразвитая поверхность раздела между дисперсной фазой и дисперсионной средой в коллоидных системах создаёт большой избыток поверхностной энергии. Поэтому с увеличением дисперсности (или удельной поверхности) коллоидные системы становятся менее устойчивыми. Они всегда стремятся к самопроизвольному уменьшению межфазной поверхности, т.е. к снижению дисперсности: частицы укрупняются, образуя более крупные агрегаты.
Свойство коллоидных систем увеличивать размер частиц путём их агрегации называется агрегативной неустойчивостью.
Для получения устойчивой коллоидной системы необходимо присутствие в системе стабилизатора. В большинстве случаев стабилизатором является электролит, находящийся в растворе. Один из ионов электролита адсорбируется на поверхности коллоидных частиц, сообщая им одноимённый заряд, препятствующий их агрегатированию (слипанию). Ионы противоположного знака находятся в дисперсионной среде.
9.2. Получение коллоидных систем
Благодаря тому, что коллоидные системы занимают промежуточное положение между грубодисперсными и молекулярно-дисперсными системами, их можно получить принципиально различными методами.
а) дисперсионные методы: дробление более крупных по размеру частиц до коллоидной степени дисперсности механическим измельчением частиц, электрическим диспергированием и ультразвуковым методом;
б) конденсационные методы: укрупнение частиц путём соединения (конденсации) атомов и молекул в агрегаты с коллоидно-дисперсной степенью дисперсности ; к этой группе методов относят получение золей конденсацией паров, заменой растворителя и с помощью различных химических реакций (метод химической конденсации).
Дисперсные системы (образование, свойства и устойчивость коллоидных растворов)
Основные условия, необходимые для получения и длительного хранения коллоидных систем, независимо от способов их получения, следующие:
нерастворимость частиц дисперсной фазы в дисперсионной среде;
достижение коллоидной степени дисперсности (10 —5 – 10 —7 см) частицами дисперсной фазы;
наличие в системе третьего компонента — стабилизатора, который сообщает системе агрегативную устойчивость.
9.3. Строение мицелл золей
В настоящее время общепринятой теорией строения коллоидных частиц является мицеллярная теория, согласно которой мицелла — это агрегат молекул и ионов, состоящий из ядра и двойного электрического слоя. А двойной электрический слой состоит из адсорбционного слоя родственных ионов и противоионов и диффузного слоя противоионов. Мицелла электронейтральна, т.к. в ней число положительных ионов равно числу отрицательных. В электрическом поле коллоидные частицы перемещаются с постоянной скоростью к одному из электродов , т.к. обладают одноимённым зарядом (либо положительным, либо отрицательным) . Наличие одноимённого заряда у всех частиц данного золя является важным фактором его устойчивости. Заряд препятствует слипанию, укрупнению и выпадению в осадок коллоидного вещества.
Чаще всего причиной возникновения заряда является процесс адсорбции ионов того или иного знака поверхностью частиц. По правилу Пескова-Фаянса: на любой твёрдой поверхности будут адсорбироваться те ионы, которые имеют с этой поверхностью общую родственную атомную группировку и находятся в растворе в избытке.
Пример 1. Примером получения золя методом двойного обмена может служить реакция 2H3AsO3 + 3H2S As2S3 + 6H2O , в случае, если одно из веществ взято в избытке (оно будет выполнять роль стабилизатора), а другое – в недостатке (что предотвращает рост зародышей коллоидных частиц до крупных размеров). При избытке, например, H2S, идёт реакция
В данных условиях молекулы As2S3, конденсируясь, образуют ядро мицеллы m[As2S3].
Известно, что вещество, которое берётся в избытке, является стабилизатором. В данном случаe им будет H2S , которая диссоциирует по уравнению:
По правилу Пескова-Фаянса на ядре m[As2S3] будут адсорбироваться ионы nHS – (как родственные и находящиеся в растворе в избытке). Эти ионы плотно прилегают к ядру и называются потенциалопределяющими. Они определяют направление движения коллоидной частицы при электролизе.
Далее отрицательно заряженные ионы HS – притягивают из раствора часть находящихся в избытке ионов Н + , образующих адсорбционный слой противоионов (n-x)H + .
Ядро m[As2S3], адсорбционный слой ионов nHS – и противоионов
(n-х)Н + образуют гранулу, несущую отрицательный заряд, т.к. ионов nHS — больше, чем (n-х)H + на число х.
Другая часть противоионов хН + образуют диффузную часть двойного электрического слоя, окружающего ядро мицеллы.
Схема строения мицеллы золя сульфида мышьяка:
В электрическом поле гранула, имеющая отрицательный заряд, перемещается к аноду, а противоионы – к катоду.
9.4. Явление коагуляции
Коагуляция — процесс слипания частиц с образованием более крупных агрегатов. Внешне коагуляция проявляется в помутнении золя, в изменении окраски золя, в выпадении твёрдой фазы в осадок или в образовании студнеобразной массы.
Коагуляция происходит вследствие уменьшения электрокинетического

( или потенциала или вследствие потери сольватной оболочки.
Коагуляцию коллоидных растворов можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, прибавлением к золю электролита.
Наиболее изучена коагуляция при добавлении к золю электролитов. Коагуляция электролитами подчиняется правилам Шульце-Гарди, которые можно сформулировать следующим образом:
1) коагуляцию вызывает ион, заряженный противоположно грануле золя;
2) чем больше заряд коагулирующего иона, тем сильнее его коагулирующее действие.
Минимальное количество электролита, прибавляемое к золю, которое может вызвать коагуляцию золя, называют порогом коагуляции С(пор) моль/л.
Примеры решения задач
Пример 2. Определение заряда коллоидных частиц.
Золь иодида серебра AgJ получен при добавлении к 0,02 л 0,01н. раствора KJ 0,028 л 0,005 н. AgNO3. Определите заряд полученного золя и напишите формулу его мицеллы.
При смешивании растворов AgNO3 и KJ протекает реакция:
Определяем количества AgNO3 и KJ, участвующих в реакции:
а) n (AgNO3 )= 0,005 . 0,028 = 1,4 . 10 -4 (моль);
б) n (KJ) = 0,02 . 0,01 = 2,0 . 10 -4 (моль).
Расчёт показывает, что в растворе избыток KJ, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы J – и частицы золя приобретают отрицательный заряд. Противоионами являются ионы К + . Формула мицеллы золя иодида серебра при условии избытка KJ имеет вид:
Пример 3. Определение минимального объёма электролита, необходимого для получения золя.
Какой объём 0,002 н. раствора BaCl2 надо прибавить к 0,03 л 0,0006 н.Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4.
Образование золя BaSO4 происходит по уравнению:
Если вещества участвуют в стехиометрических соотношениях, то для реакции необходимо:
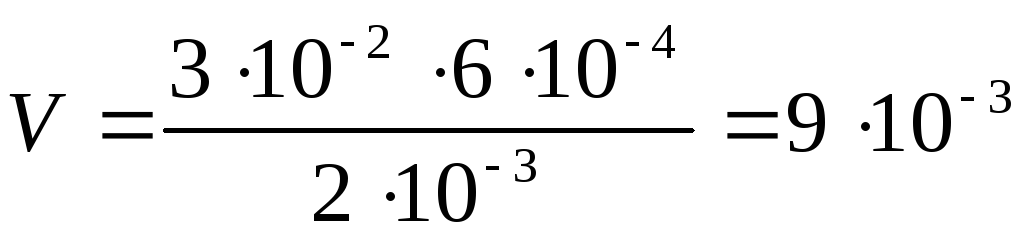
(л) раствора BaCl2
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять более 0,009 л 0,002 н. раствора BaCl2.
Формула мицеллы золя сульфата бария:

Пример 4. Вычисление порога коагуляции электролита с учётом его концентрации.
В каждую из трёх колб налито по 0,01 л золя хлорида серебра. Для коагуляции этого золя в первую колбу добавлено 0,002 л 1н. NaNO3, во вторую – 0,012 л. 0,01н. Сa(NO3)2; в третью – 0,007 л. 0,001н. Al(NO3)3.
Вычислите пороги коагуляции электролитов, определите знак заряда частиц золя.
Минимальное количество электролита, прибавляемого к золю, которое может вызвать коагуляцию золя, называется порогом коагуляции Спор (ммоль/л) . Порог коагуляции может быть рассчитан по формуле:

где СЭ — эквивалентная концентрация электролита (моль/л);
VЭл , VЗ — соответственно объёмы электролита и золя, л.
Вычисляем пороги коагуляции добавляемых электролитов:



Добавляемые электролиты – NaNO3 , Ca(NO3)3 и Al(NO3)3 cодержат анион NO3 — и катионы Na + , Ca 2+ , Al 3+ разной зарядности. Наименьший порог коагуляции у Al(NO3)3, следовательно, частицы золя хлорида серебра заряжены отрицательно.
Пример 5. Расчёт порога коагуляции.
Пусть молярная концентрация исходного электролита будет равна С, объём его, вызвавший коагуляцию, V; тогда число миллимолей электролита:

.
Порог коагуляции относится к одному литру золя, и если для его определения было взято w мл золя, то величина порога коагуляции будет:

(ммоль/л)
Контрольное задание
При достаточно медленном введении вещества В в разбавленный раствор вещества А возможно образование гидрозоля вещества С.
а) Напишите формулу мицеллы золя и укажите знак заряда коллоидных частиц этого золя.
б) Какое из рекомендованных веществ является наиболее эффективным коагулятором этого золя?
Источник: studfile.net
Примеры решения задач. Пример 1. Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 М раствора KI 0,028 л 0,005М раствора AgNO3
Пример 1. Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 М раствора KI 0,028 л 0,005М раствора AgNO3. Определите заряд частиц полученного золя и напишите формулу его мицеллы.
Д а н о: С KI = 0,01 моль/л; С AgNO3 = 0,005 моль/л, V KI = 0,02 л; V AgNO3 = 0,028 л.
Определить заряд полученного золя. Написать формулу мицеллы золя.
Р е ш е н и е. При смешении растворов AgNO3 и KI протекает реакция: AgNO3 + KI = AgI + KNO3
Определяем количество AgNO3 и KI, участвующих в реакции:
СVAgNO3 = 0,005×0,028 = 1,4×10 -4 моль
CVKI = 0,02×0,01 = 2,0×10 -4 моль
Расчет показывает, что в растворе избыток KI, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы I – и частицы золя приобретают отрицательный заряд. Противоионами являются ионы К + . Формула мицеллы золя иодида серебра при условии избытка KI:
Пример 2. Какой объем 0,002 М раствора BaCl2 надо добавить к 0,03 л 0,0006 М раствора Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4.
Найти V BaCl2. Написать формулу мицеллы золя.
Р е ш е н и е. Образование золя BaSO4 происходит в соответствии с уравнением реакции: 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2 AlCl3
Если вещества участвуют в стехиометрическом соотношении, то справедливо соотношение: (CV)BaCl2 = (CV) Al2(SO4)3, следовательно
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Значит, для реакции необходимо взять более 0,009 л 0,002М раствора BaCl2. Формула мицеллы золя сульфата бария: <[mBaSO4] ×nBa 2+ 2(n-x)Cl – > 2 x + ×2xCl –
Пример 3. Золь сульфида цинка был получен при взаимодействии растворов Zn(NO3)2 и Na2S. Определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к аноду. Напишите формулу мицеллы золя.
Р е ш е н и е. Образование золя ZnS происходит в соответствии с уравнением реакции: Zn(NO3)2 + Na2S = ZnS + 2NaNO3
Анод – положительно заряженный электрод, к нему движутся отрицательно заряженные частицы. Значит противоионы мицеллы имеют отрицательный заряд, а сама мицелла заряжена положительно, что возможно при условии избытка Zn(NO3)2. На поверхности агрегата ZnS адсобируются потенциалопределяющие ионы Zn 2+ (так как раствор Zn(NO3)2 в избытке), создавая таким образом положительный заряд мицеллы. Агрегат и потенциалопределяющие ионы образуют ядро, с которым связываются противоионы – NO3 – .
Таким образом, в избытке был взят раствор Zn(NO3)2. Формула мицеллы золя иодида серебра при условии избытка Zn(NO3)2:
Источник: studopedia.su
Золь иодида серебра получен по реакции KI+AgNO3=AgI+KNO3 при некотором избытке KI Его коагулируют растворами сульфата
Коагулирующая способность у сульфата натрия больше, чем у ацетата кальция. Схема мицеллы золя: AgI → Ag⁺ + I⁻. I⁻ и Ag⁺ образуют кристаллическую решетку, которая омывается ионами K⁺ и I⁻, образуя мицеллу золя.
Как добавить хороший ответ?
Что необходимо делать:
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Что делать не стоит:
- Списывать или копировать что-либо. Высоко ценятся ваши личные, уникальные ответы;
- Писать не по сути. «Я не знаю». «Думай сам». «Это же так просто» — подобные выражения не приносят пользы;
- Писать ответ ПРОПИСНЫМИ БУКВАМИ;
- Материться. Это невежливо и неэтично по отношению к другим пользователям.
Пример вопроса
Русский язык
7 минут назад
Какой синоним к слову «Мореплаватель»?
Пожаловаться
Хороший ответ
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Источник: uchi.ru