В физике и химии существует такое понятие как твердые тела. Основными свойствами твердых тел являются возможности сохранения объема и формы. По типу внутреннего строения они делятся на кристаллические и аморфные. К первым относятся поваренная соль, металлы, сахар, графит, минералы и т.д., ко вторым – стекло, смолы, пластмассы, воск и т.д. Чем же отличаются аморфные вещества от кристаллических?

Кристаллическое строение отличается упорядоченностью и значительным расстоянием между частицами. Вещества, атомы и молекулы которых расположены более хаотично и на близком расстоянии, называются аморфными. По своему строению они близки к жидкостям.
Существует способ визуального определения кристаллических и аморфных тел: на изломе кристаллы имеют плоские грани и ступенчатую поверхность, в то время как аморфные тела образуют поверхность неправильной формы.
Аморфное состояние веществ считается неустойчивым. Многие такие тела со временем могут стать кристаллами. К примеру, расплавленный сахар при застывании приобретает твердое состояние. И наоборот, некоторые тела с кристаллическим строением при нагревании пребывают в аморфном состоянии.
ЙОД Вам не поможет!!!Я покажу как ПРАВИЛЬНО ПРОВЕРИТЬ ЗОЛОТО и СЕРЕБРО в домашних условиях!

а) кристаллическое вещество б) аморфное вещество
Вещества с аморфным строением имеют одинаковые свойства по различным направлениям межмолекулярных связей. Это свойство называется изотропией. То есть при повышении температуры такие тела получают «текучесть». Однако, в отличие от кристаллических тел, аморфные вещества не имеют фиксированной температуры плавления.
Атомы и молекулы, образующие кристаллическое тело, располагаются в виде разнообразных пространственных решеток, напоминающих геометрические формы. К примеру, монокристалл поваренной соли выглядит как куб, а алмаза – как правильный шестигранник. В естественных природных условиях монокристаллы встречаются редко. Как правило, большинство кристаллических тел состоит из малых, беспорядочно сросшихся между собой, монокристаллов. Такое тело получило название поликристалл.
Монокристаллы зависят от направления ориентации кристаллических граней. Данное свойство называется анизотропией. Поликристаллы же изотропны по своим свойствам, что обусловлено хаотичностью ориентации монокристаллов, из которых они состоят.
Выводы:
- Частицы аморфных веществ не имеют определенного расположения, в то время как молекулы и атомы кристаллов упорядочены.
- В кристаллических веществах частицы расположены на значительном расстоянии друг от друга.
- Аморфные вещества не имеют фиксированной температуры плавления.
- Кристаллические вещества лучше сохраняют форму.
- Аморфные вещества по свойствам близки к жидкостям, кристаллические – к твердым телам.
- Аморфное состояние веществ считается неустойчивым.
- Вещества с аморфным строением характеризуются изотропией, кристаллы — анизотропией.
Ресурсы:
Габриелян О.С., Лысова Г.Г. «Химия 11 класс»
Источник: thedb.ru
Отличие кристаллических и аморфных тел: сравнение свойств

Каждый школьник знает, что любое вещество на планете может существовать в одном из четырех агрегатных состояний. Большой интерес в физике представляют собой твердые тела. По своей структуре их разделяют на два основных класса: кристаллические и аморфные. Отличием тел друг от друга занимается специальный раздел физики конденсированного состояния.
Твердое вещество
В термодинамике существует понятие об энергии Гиббса, минимум которой является достаточным критерием для существования определенной фазы в конкретно заданных условиях. Основные параметры окружающей среды, от которых зависит энергия Гиббса, это температура и давление.
По мере увеличения температуры и уменьшения давления можно наблюдать следующую последовательность переходов между агрегатными состояниями одного и того же с точки зрения химии вещества:

- Плазма.
- Газ.
- Жидкость.
- Твердое тело.
Таким образом, твердое вещество является энергетически стабильным при низких температурах и высоких давлениях, причем обе величины оказывают независимый вклад в функцию энергии Гиббса.
В отличие от других агрегатных состояний твердое характеризуется следующими особенностями, которые присущи только ему:
- Способность сохранять свою форму. Любому механическому воздействию твердое тело оказывает сопротивление.
- Постоянство объема. Чтобы изменить объем газа, достаточно его поместить в любой другой сосуд. Для изменения же этой величины для твердого вещества придется приложить значительное внешнее механическое усилие.
Примерами являются деревянная палка, кусок металла, стекло, золотое украшение, пластиковый корпус компьютера и так далее. Все эти предметы способны длительное время сохранять свою форму и не изменять объем.
Характеристика кристаллических и аморфных тел
Чтобы ясно понять, чем отличаются аморфные вещества от кристаллических, необходимо с каждым из этих классов познакомиться отдельно. Отличить один вид от другого часто только по внешним признакам не удается, поскольку оба имеют признаки твердого соединения. Многие люди иногда путают их между собой. Например, красивые стеклянные фрески ошибочно воспринимают кристаллами, а сосульки на крышах домов считают неверно аморфными соединениями.
Основное отличие между двумя классами веществ заключается в особенностях их внутреннего строения, в основе которого лежит пространственное расположение структурных единиц (атомов, молекул).
Упорядоченное строение
Кристаллы являются достаточно обширным классом веществ. Для них характерна строгая периодичность в пространстве составляющих их структурных единиц. Последние носят название элементарных ячеек.

Наука, которая занимается изучением этого подвида твердых тел, называется кристаллографией. В ней для описания геометрических свойств монокристаллов вводят координатные оси. В большинстве случаев используют декартову прямоугольную систему координат, с которой удобно работать на практике. Если взять определенную группу атомов или молекул и перемещать ее на элементарные векторы вдоль каждой из трех взаимно перпендикулярных осей, то получится весь объем кристалла. Используемая при этом группа атомов называется элементарной ячейкой.
Поскольку периодичность в кристаллах может отличаться величинами элементарных векторов трансляции и характером расположения атомов в выбранной для перемещения группе, то в кристаллографии вводят несколько сингоний (кристаллических систем имеющих определенную пространственную группу симметрии). Их 6, и следует их расположить в таком порядке:
- Триклинная.
- Моноклинная.
- Орторомбическая.
- Тетрагональная.
- Гексагональная.
- Кубическая.
Чем больше номер сингонии, тем более высокой симметрией обладают ее кристаллы. Так, кубическая — это самая симметричная система. Ей обладают большинство металлов. Например, медь, серебро, золото и алюминий имеют гексагональную гранецентрированную кубическую решетку (ГЦК).
В свою очередь, железо, вольфрам, ниобий, молибден, ванадий — это представители объемноцентрированной кубической решетки (ОЦК). Некоторые металлы характеризуются гексагональной сингонией (ГПУ), например, кобальт, титан и цирконий.
Аллотропные модификации
Необходимо вспомнить о существовании так называемых аллотропных модификациях. Они представляют собой разное кристаллическое строение одного и того же по своему химическому составу вещества.
Здесь будет наглядным привести пример железа при атмосферном давлении. Когда температура окружающей среды меньше 911 градусов по Цельсию, то его стабильной является решетка ОЦК. Как только температура становится выше, происходит перестройка структуры в более выгодное энергетическое состояние. Выше 911 градусов железо имеет решетку ГЦК. В промежутке температур 1392−1539 градусов по Цельсию снова образуются кристаллы ОЦК.

Другим примером является олово. Оно бывает двух аллотропных модификаций: белое и серое. Первая из них представляет собой высокотемпературную (выше 13 градусов) и обладает высокой пластичностью, свойственной любому металлу. Серое же олово существует в стабильном состоянии при температурах ниже 13 градусов и характеризуется высокой хрупкостью. Именно поэтому не следует использовать оловянную посуду при низких температурах, поскольку она просто-напросто превратится в пыль.
Анизотропия свойств

В какой бы аллотропной форме ни находилось кристаллическое вещество, оно всегда характеризуется анизотропией физических свойств. Причина этого — все то же упорядоченное строение. Например, поваренная соль при попадании в воду растворяется строго по определенным плоскостям, которые являются наиболее плотноупакованными. Другой пример — кристалл турмалина, в зависимости от того, в каком направлении относительно него падает луч света, он может проявлять или не проявлять свойства двойного лучепреломления.
Уникальным свойством многих кристаллов, подтверждающим их анизотропный характер, является отнесение многих из них к классу пьезо- или пироэлектриков. Так, механическая деформация в определенном направлении или локальный нагрев приводят к появлению разности потенциалов между двумя точками кристалла.
Весьма наглядным примером является также графит. Для него характерно наличие плотноупакованных гексагонов, которые соединены друг с другом слабыми пи-связями. Даже небольшое механическое усилие, направленное перпендикулярно этим связям, приводит к расслоению графита.
Отсутствие дальнего порядка
Аморфные вещества — это твердые тела, которые не обладают характерным для кристаллов дальним порядком. Иными словами, в них нельзя выбрать элементарную ячейку и оси трансляции таким образом, чтобы с помощью ее переноса на определенные вектора получить весь объем.
Детальное изучение амфотерных соединений и их сравнение с кристаллами привело ученых к выводу, что они все же обладают так называемым ближним порядком (сходство с кристаллическим состоянием). Этот факт можно объяснить тем, что каждый атом или молекула обладает способностью образовать определенное количество связей (ковалентных, диполь-дипольных, ионных, водородных и другие) до их насыщения. Кроме того, само пространство вокруг частицы является ограниченным, и в случае плотной упаковки в нем может расположиться лишь определенное количество атомов или молекул.

Практически любое твердое тело можно получить в аморфном виде. Для этого необходимо его расплав или газовую фазу охладить с высокой скоростью. В случае металлов она должна достигать миллионов градусов в секунду. Полученные в таких условиях аморфные ленты обладают рядом уникальных характеристик. Если сравнить их с аналогичными свойствами для кристаллов, то можно выделить следующее:
- изотропность;
- особое электронное строение (отсутствие четких валентных зон и зон проводимости, которые свойственны кристаллам);
- иные коэффициенты упругости, чем для кристаллов, и практически полное отсутствие пластичности при низких температурах;
- отсутствие аллотропных модификаций.
Аморф — это хаос в расположении составляющих его частиц, поэтому не идет никакой речи об аллотропных модификациях или анизотропии свойств в таких веществах. Также для них нет четкой температуры плавления, поскольку это твердое тело напоминает собой застывшую жидкость. Если его нагревать, то оно плавно будет уменьшать свою вязкость. Примером может служить любой пластик. Его нагрев приводит к постепенному появлению мягкости и тягучести.
Причина отличия свойств
Из описания характеристик кристаллов и аморфных веществ следует, что они различаются практически во всем, кроме того факта, что оба относятся к твердому агрегатному состоянию. Тем не менее у всех этих физических различий имеется лишь одна-единственная причина — пространственная структура на микроскопическом уровне.

Если наблюдается дальний порядок и периодичность в расположении элементарных структурных единиц, то вещество является кристаллом и для него характерны анизотропия, полиморфизм, четкий переход в жидкое состояние. Если же дальнего порядка в расположении частиц нет, а существует только их ближнее упорядочивание, то можно говорить, что его свойства по всем направлениям одинаковы, отсутствует полиморфизм и температурная точка плавления.
Различие характеристик кристаллов и аморфных веществ позволяет человеку значительно изменять свойства твердых тел с использованием только физических методов воздействия, что открывает широкие возможности для применения их для нужд жизнедеятельности. Изменение химического состава вещества может создавать условия для его кристаллизации или аморфизации.
Источник: na5.club
Кристаллические и аморфные вещества
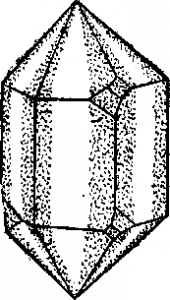
Подавляющее большинство твердых тел имеет правильное кристаллическое строение. Однако при понижении температуры некоторые жидкости могут затвердевать без упорядочения структуры. Образующиеся при этом вещества называются аморфными. К ним относятся, например, обычное стекло и каучук. Исследования аморфных ве ществ показывают, что они состоят из беспорядочно расположенных мельчайших кристаллических образований.
Структура твердых тел зависит главным образом от условий, в которых происходит переход из жидкого (а в некоторых случаях — из газообразного) в твердое состояние. Если такой переход осуществляется очень быстро, например, при резком охлаждении жидкости ниже температуры плавления, частицы не успевают выстроиться в правильную структуру и образуется аморфное или мелкокристаллическое вещество. При медленном охлаждении жидкости получаются крупные и правильной формы кристаллы. Подбирая соответствующие условия, можно получить в кристаллическом состоянии почти все типично аморфные вещества.
Рис. Распределение порошков серы и сурика па поверхности наэлектризованного кристалла горного хрусталя
В некоторых случаях, для того чтобы аморфное вещество закристаллизовалось, его приходится выдерживать при различных температурах. Например, для получения кристаллических стекол — ситаллов — расплавленное стекло сначала охлаждают до оптимальной температуры образования зародышей кристаллизации, некоторое время выдерживают при этой температуре, затем вновь нагревают для более быстрого роста кристаллов и спустя некоторое время окончательно охлаждают. В результате такой последовательности операций получается стекло, состоящее из равномерно распределенных по всему объему мелких кристалликов, спаянных друг с другом пленками аморфного вещества. Ситаллы обладают исключительно высокой прочностью и применяются для многих строительных работ.
Различие между кристаллическими и аморфными веществами особенно сильно проявляется в их отношении к нагреванию. В то время как любое кристаллическое тело плавится при строго определенной температуре, аморфные вещества постоянной точки плавления не имеют. С повышением температуры они постепенно размягчаются, начинают растекаться и, наконец, становятся совсем жидкими. Установить момент перехода аморфного вещества из твердого состояния в жидкое не представляется возможным. Поэтому аморфные тела можно считать просто очень вязкими жидкостями.
Другим характерным свойством, отличающим кристаллические вещества от аморфных, является анизотропия или неравно свойственность кристаллов. Так, если из кубика хлорида натрия вырезать в различных направлениях три столбика одинакового поперечного сечения и испытать их на разрыв, то окажется, что все они имеют различную прочность. Столбик, соединяющий противоположные грани куба, разорвется при нагрузке 570 г/мм 2 . Точно такой же столбик, вырезанный параллельно диагонали грани куба, выдержит напряжение вплоть до 1150 г/мм 2 , А столбик, вырезанный по пространственной диагонали куба, окажется самым прочным: он разорвется при усилии, превышающем 2150 г/мм 2 . Если проделать аналогичный опыт со стеклянным кубиком (аморфное вещество), то таких различий в свойствах мы уже не встретим.
Вследствие неодинаковой механической прочности в различных направлениях кристаллы при ударе способны раскалываться по определенным плоскостям. Это их свойство называется спайностью. Например, свинцовый блеск (PbS) и хлорид натрия образуют при дроблении правильные кубы, плавиковый шпат (СаF2) — октаэдры, а слюда — пластинки. Если одну из таких пластинок покрыть тонким слоем воска или парафина и прикоснуться к ней острым концом тонкой стеклянной палочки, получится овальное пятно, форма которого доказывает, что теплопроводность слюды анизотропна.
Очень интересными являются электрические свойства кристаллов. Они электризуются при трении, сжатии, растяжении и, кроме того, при изменении температуры. Если большой и хорошо образованный кристалл горного хрусталя нагреть в закрытом сосуде, а затем быстро охладить, то он, подобно натертому о сукно янтарю, начинает притягивать мелко нарезанную папиросную бумагу.
Однако в отличие от янтаря или эбонитовой палочки хрусталь электризуется неравномерно. В этом нетрудно убедиться, проделав следующий опыт: наэлектризуйте кристалл горного хрусталя. Приготовьте однородную смесь из тонко измельченных порошков сурика (минеральная краска, содержащая до 60% оксида железа) и серы и заполните ею солонку или перечницу.
Сделайте из марли небольшое сито; для этого натяните кусок марли на пяльцы или любой другой обруч. Возьмите в одну руку сито, в другую — солонку и осторожно, небольшими порциями, высыпайте порошок на сито, под которым лежит наэлектризованный кристалл горного хрусталя.
Порошок не ляжет равномер но по всей поверхности кристалла, а покроет только его ребра, которые станут попеременно желтыми и красными (рис.). Неожиданный результат опыта объясняется тем, что частички серы и сурика, проходя сквозь отверстия в марле, наэлектризовались от трения друг о друга. Сера зарядилась отрицательно, а сурик — положительно. Падая на кристалл, наэлектризованные частички притянулись его противоположно заряженными частями и образовали полосы. Если проделать аналогичный эксперимент с кристаллом турмалина, то один его конец станет красным от сурика, а другой желтым от серы.
Источник: znaesh-kak.com