Амфотерные металлы – это простые вещества, которые по структуре, химическим и физическим свойствам сходны с металлической группой элементов. Сами по себе металлы не могут проявлять амфотерных свойств, в отличие от их соединений. Например, оксиды и гидроксиды некоторых металлов обладают двойственной химической природой – в одних условиях они ведут себя как кислоты, а в других обладают свойствами щелочей.
Основные амфотерные металлы – это алюминий, цинк, хром, железо. К этой же группе элементов можно отнести бериллий и стронций.
Что такое амфотерность?
Впервые это свойство было обнаружено достаточно давно. А термин «амфотерные элементы» был введен в науку в 1814 году известными химиками Л. Тенаром и Ж. Гей-Люссаком. В те времена химические соединения принято было разделять на группы, которые соответствовали их основным свойствами во время реакций.
Тем не менее, группа оксидов и оснований обладала двойственными способностями. В некоторых условиях такие вещества вели себя как щелочи, в других же, наоборот, действовали как кислоты. Именно так и возник термин «амфотерность». Для таких химических веществ поведение во время кислотно-основной реакции зависит от условий ее проведения, природы участвующих реагентов, а также от свойств растворителя.
Химические свойства амфотерных оксидов. Амфотерность.
Интересно, что в естественных условиях амфотерные металлы могут взаимодействовать как с щелочью, так и с кислотой. Например, во время реакции алюминия с сульфатной кислотой образуется сульфат алюминия. А при реакции этого же метала с концентрированной щелочью образуется комплексная соль.
Амфотерные основания и их основные свойства
При нормальных условиях это твердые вещества. Они практически не растворяются в воде и считаются довольно слабыми электролитами.
Основной метод получения таких оснований – это реакция соли металла с небольшим количеством щелочи. Реакцию осаждения нужно проводить медленно и осторожно. Например, при получении гидроксида цинка в пробирку с хлоридом цинка осторожно, каплями добавляют едкий натр. Каждый раз нужно несильно встряхивать емкость, чтобы увидеть белый осадок металла на дне посуды.
С кислотами и кислотными оксидами амфотерные вещества реагируют как основания. Например, при реакции гидроксида цинка с соляной кислотой образуется хлорид цинка.
А вот во время реакций с основаниями амфотерные основания ведут себя как кислоты.
Кроме того, при сильном нагревании амфотерные гидроксиды разлагаются с образованием соответствующего амфотерного оксида и воды.
Самые распространенные амфотерные металлы: краткая характеристика
Цинк относится к группе амфотерных элементов. И хотя сплавы этого вещества широко использовались еще в древних цивилизациях, в чистом виде его смогли выделить лишь в 1746 году.
Чистый металл представляет собой достаточно хрупкое вещество голубоватого цвета. На воздухе цинк быстро окисляется – его поверхность тускнеет и покрывается тонкой пленкой оксида.
В природе цинк существует преимущественно в виде минералов – цинкитов, смитсонитов, каламитов. Самое известное вещество – это цинковая обманка, которая состоит из сульфида цинка. Самые большие месторождения этого минерала находятся в Боливии и Австралии.
ЦИНК Амфотерный металл Химические свойства Задание 7 Химия ЕГЭ 2016 Видеоурок Репетитор химии
Алюминий на сегодняшний день считается наиболее распространенным металлом на планете. Его сплавы использовались на протяжении многих столетий, а в 1825 году вещество было выделено в чистом виде.
Чистый алюминий представляет собой легкий металл серебристого цвета. Он легко поддается механической обработке и литью. Этот элемент обладает высокой электро- и теплопроводностью. Кроме того, данный металл стоек к коррозии. Дело в том, что поверхность его покрыта тонкой, но очень стойкой оксидной пленкой.
На сегодняшний день алюминий широко применяется в промышленности.
Источник: fb.ru
Амфотерные металлы
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность. Надо отметить, что это не сами металли, а их соли или оксиды. К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.

Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.

Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Кстати, самым ярким представителем амфорных металлов считают алюминий.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду. Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей.
В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам. В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии. При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой.
Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре. Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур.
Может быстро начинать коррозировать под воздействием высоких температур. Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Свойства амфотерных металлов
Они определены самим понятием амфотерности. В типовом состоянии, то есть обычной температуре и влажности, большая часть металлов представляет собой твердые тела. Ни один металл не подлежит растворению в воде. Щелочные основания проявляются только после определенных химических реакций. В процессе прохождения реакции соли металла вступают во взаимодействие.
Надо отметить что правила безопасности требуют особой осторожности при проведении этой реакции.
Соединение амфотерных веществ с оксидами или самими кислотами первые показывают реакцию, которая присуща основаниями. В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
Нагрев амфотерных гидроксидов вынуждает их распадаться на воду и оксид. Другими словами свойства амфотерных веществ весьма широки и требуют тщательного изучения, которое можно выполнить во время химической реакции.
Свойства амфотерных элементов можно понять, сравнив их с параметрами традиционных материалов. Например, большинство металлов имеют малый потенциал ионизации и это позволяет им выступать в ходе химических процессов восстановителями.
Амфотерные — могут показать как восстановительные, так и окислительные характеристики. Однако, существуют соединения которые характеризуются отрицательным уровнем окисления.
Абсолютно все известные металлы имеют возможность образовывать гидроксиды и оксиды.
Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Кстати, металлы могут вступать в реакцию окисления только с некоторыми кислотами. Например, реакция с азотной кислотой может протекать по-разному.
Амфотерные вещества, относящиеся к простым, обладают явными различиями по структуре и особенностям. Принадлежность к определенному классу можно у некоторых веществ определить на взгляд, так, сразу видно что медь – это металл, а бром нет.
Как отличить металл от неметалла
Главное различие заключается в том, что металлы отдают электроны, которые находятся во внешнем электронном облаке. Неметаллы, активно их притягивают.
Все металлы являются хорошими проводниками тепла и электричества, неметаллы, такой возможности лишены.
Основания амфотерных металлов
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Источник: prompriem.ru
Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей

Амфотерные гидроксиды проявляют свойства как основных, так и кислотных гидроксидов в зависимости от среды.
Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей
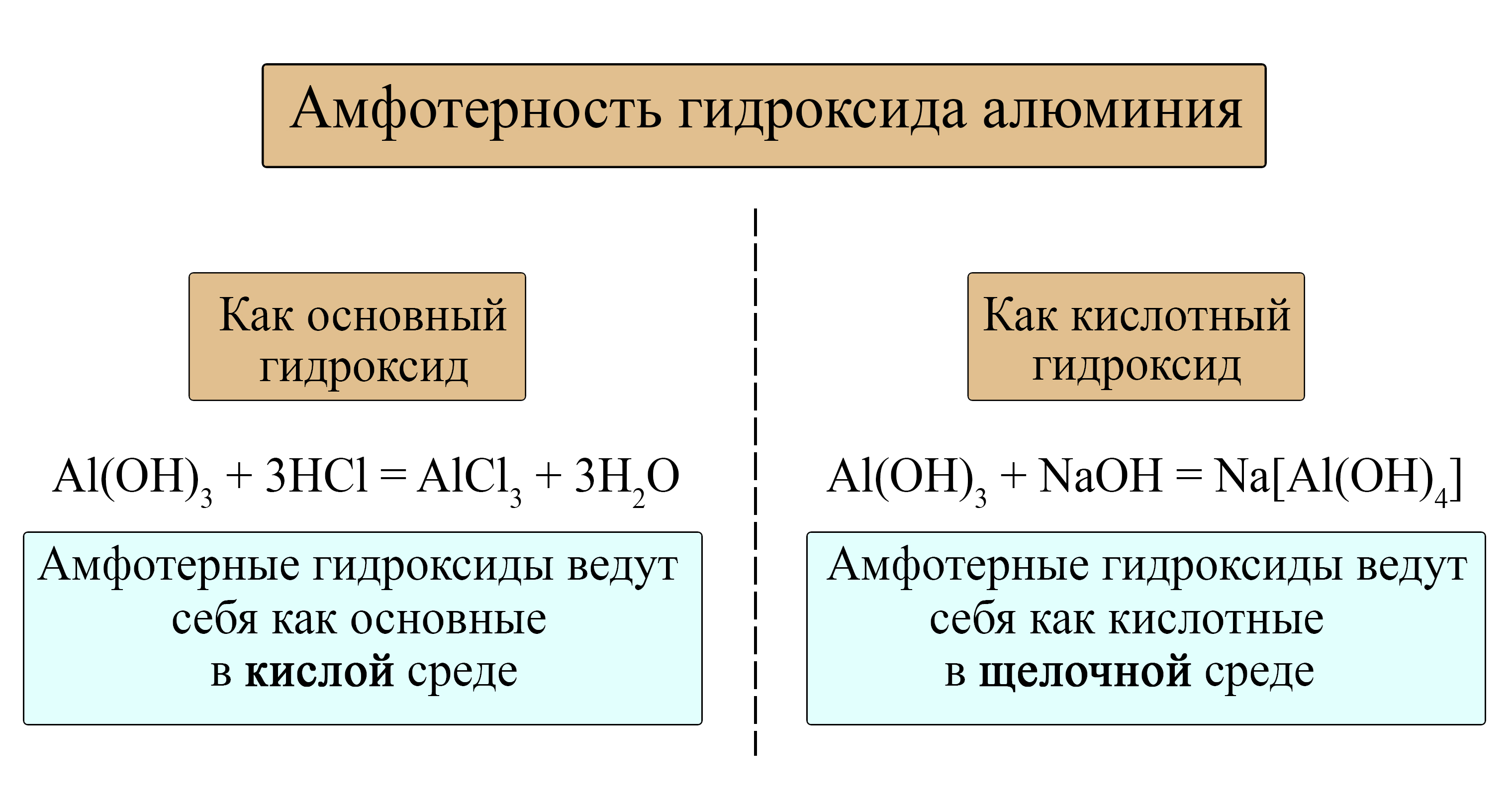
Гидроксид алюминия как кислота и как основание
Большинство металлов периодической системы могут образовывать амфотерные гидроксиды, чаще всего это гидроксиды металлов в степени окисления «+2» и «+3», а также, теоретически, гидроксиды металлов в степени окисления «+4», хотя большинство из них не выделены (для них существуют только соответствующие соли). Подробнее о классификации гидроксидов можно прочитать в статье «Классификация гидроксидов и оснований»
Химические свойства амфотерных гидроксидов
- Как уже было сказано выше, амфотерные гидроксиды ведут себя как типичные основания при реакции с кислотами:
- Амфотерные гидроксиды реагируют с твёрдыми щелочами при сплавлении и с растворами концентрированных щелочей:
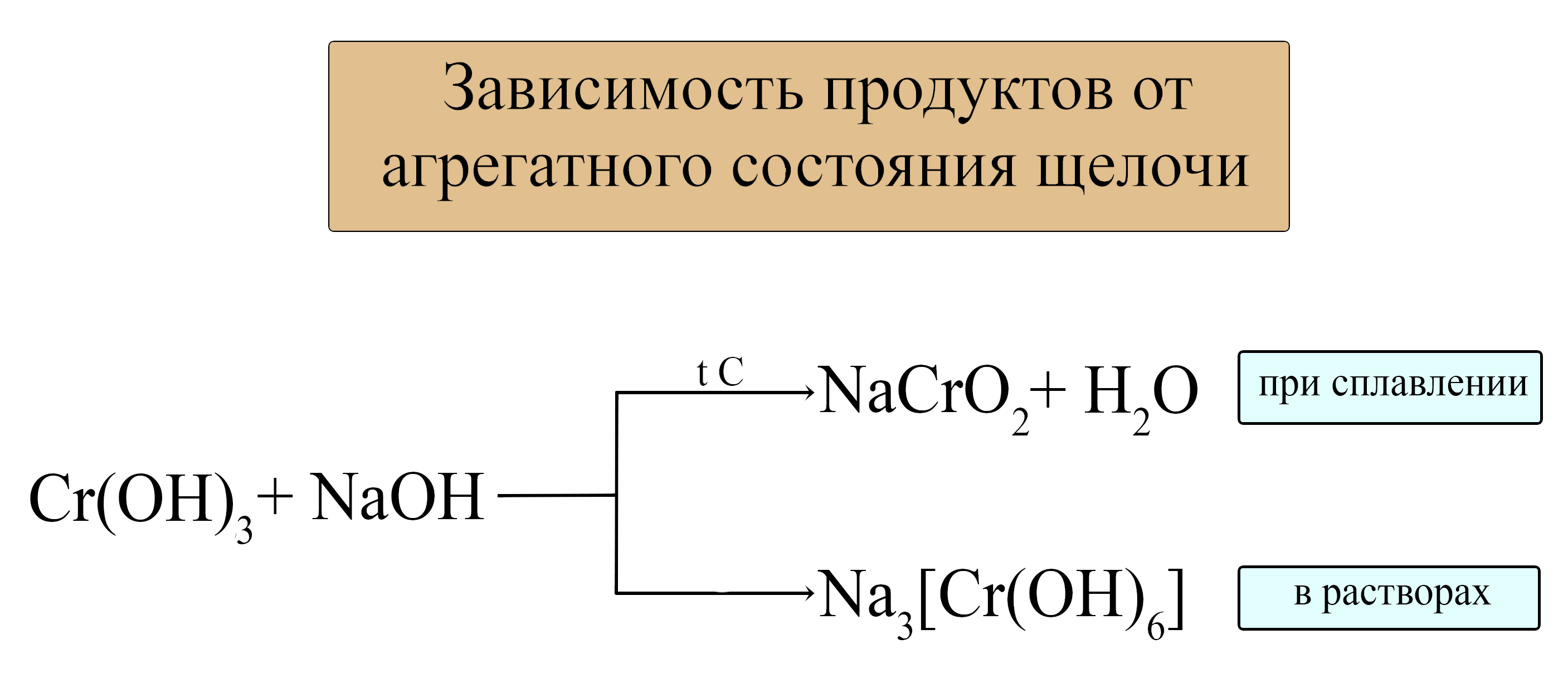
В растворах щелочей:
О том, какие анионы характерны для амфотерных оксидов и гидроксидов, Вы можете прочитать в статье «Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных»
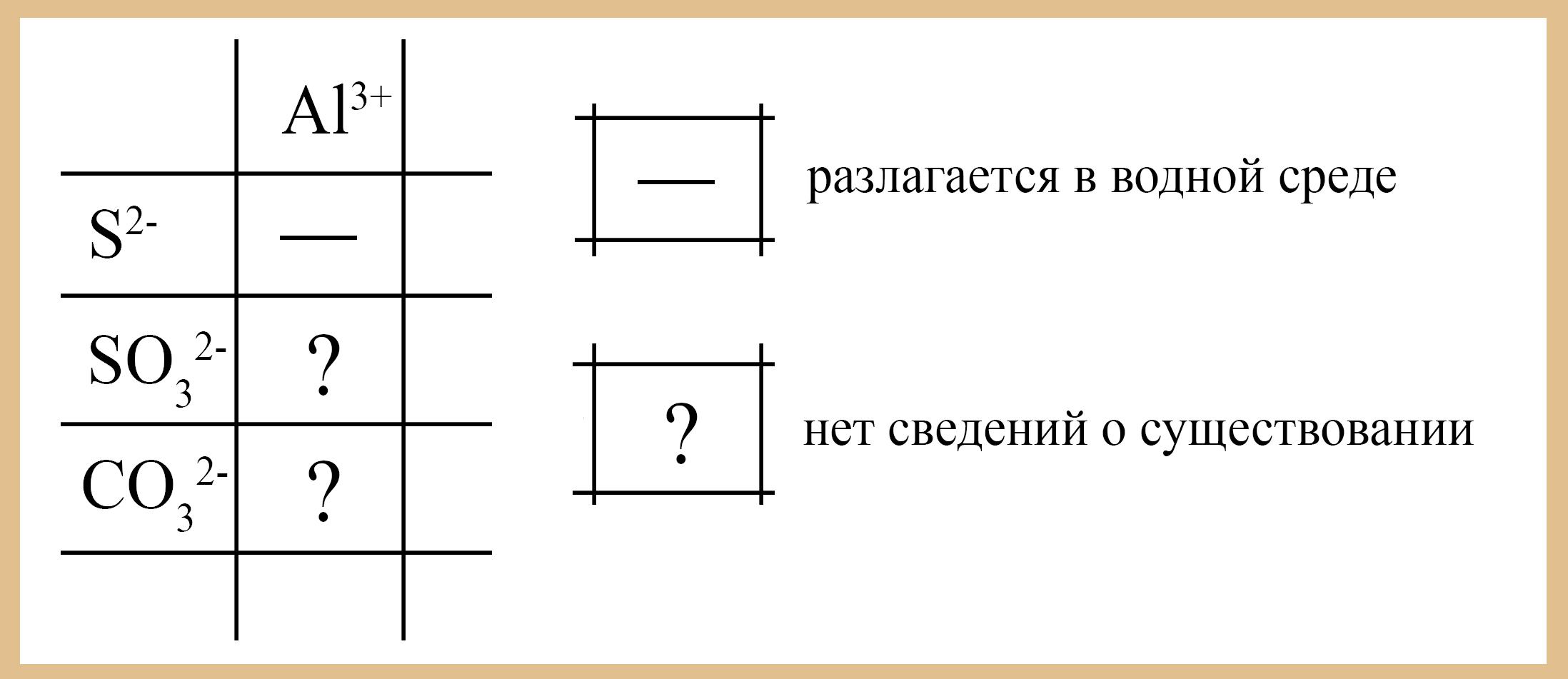
- Амфотерные гидроксиды взаимодействуют с солями, образованными щелочным металлом и анионом, с которым «амфотерный металл» не может образовать существующую или устойчивую соль (для алюминия это сульфиты, сульфиды, карбонаты, нитриты, ацетаты и силикаты). Информация о том, существует ли соль или мгновенно разлагается в водных растворах, можно получить из таблицы растворимости:
- Амфотерные гидроксиды разлагаются при нагревании на воду и соответствующих оксид (степень окисления металла в исходном гидроксиде и в полученном оксиде одинаковая):
Получение амфотерных гидроксидов
Напрямую, растворением соответствующего оксида в воде, амфотерный гидроксид получить нельзя из-за низкой растворимости в воде амфотерных оксидов. Поэтому амфотерные гидроксиды получают в основном из солей.
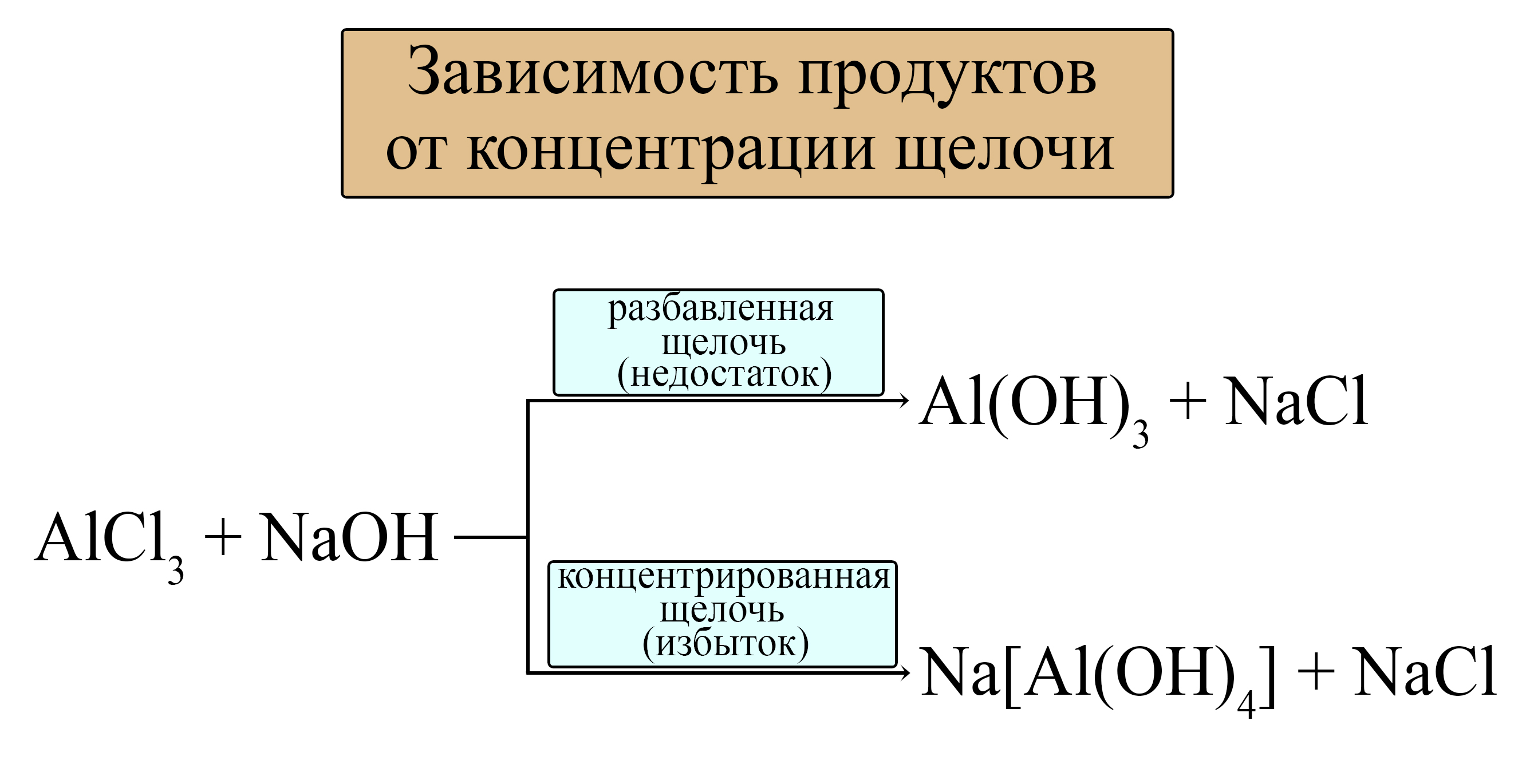
- Действием раствора щелочи на растворимую соль, содержащую металл, соединения котного могут проявлять амфотерность:
В этих реакциях не используют концентрированный раствор щелочи и большие избытки растворов щелочи, иначе образуются не амфотерные гидроксиды, а комплексные соединения:
Зависимость продукта от количества взятой щелочи можно выразить следующей схемой:
- Амфотерные гидроксиды получают действием на растворы солей, содержащих «амфотерный» металл аммиака:
- Амфотерные гидроксиды получают действием на раствор соли, содержащей «амфотерный» металл растворов солей, содержащих анион, с которым амфотерный металл не образует существующих солей или соли гидролизуются в водной среде:
- Амфотерные гидроксиды можно получить действием разбавленных кислот на гидроксокомплексы:
Если использовать избыток кислоты, то образуется не амфотерный гидроксид, а соль, так как избыток кислоты растворяет гидроксид:
- Амфотерные гидроксиды можно получить действием газа на гидроксоалюминаты, гидроксоферриты и гидроксохромиты:
Источник: onlineclass.space