Добрый день, читатели! В этой статье вы найдете информацию об одном из самых сложных процессов в химии — растворении золота. С помощью моих советов вы сможете воссоздать тяжелейшую реакцию самостоятельно и без особых навыков!
Золото — довольно малоактивный металл. В природе чаще всего оно встречается в качестве соединений. Когда неопытный химик задается целью получить чистый драгметалл, сам собой возникает вопрос, в чем растворяется золото. Без растворения выделить его невозможно. Но найти вещество, которое вступит в сложную реакцию, — непростая задача, не зря ведь золото называют благородным металлом.
Чем можно растворить золото
Долгие годы химики использовали лишь опасный метод, в котором при предельно высокой температуре золото растворяется в реакции с фтором. Но в современном мире применяют новые, более безопасные способы.
Амальгама
Амальгамой называют сплавы ртути в жидком или твердом состоянии, его используют как промышленный метод аффинажа. Процесс амальгамации золота заключается в особенности ртути образовывать соединения нескольких металлов.
Золото — САМЫЙ СТОЙКИЙ МЕТАЛЛ НА ЗЕМЛЕ!
Перед амальгамацией следует поместить самородок в раствор азотной кислоты в соотношении с водой 10:1. Золото должно находиться в растворе до полного завершения видимой реакции, после чего его необходимо промыть.
Для амальгамации драгметалл и ртуть берутся в одинаковой пропорции. В неметаллический лоток помещают оба вещества и вращают его. Шарик ртути растворяется в молекулах самородка. Ненужный осадок выливается из лотка.
Насыщенную золотом амальгаму необходимо осторожно промыть под проточной водой.
Излишки ртути из амальгамы удаляются путем продавливания шарика через мокрую замшу. Оставшееся на поверхности соединение нагревается до полного испарения ртути.
Царская водка
Большинство кислот оказывают страшное воздействие на органику. Но даже в них не растворяется золото. Знаменитое изобретение Ломоносова — царская водка — единственная кислота, способная привести в действие реакцию.

Царской водкой называют смесь соляной и азотной кислоты в особом соотношении (1:3). Ее свойства многократно усилены благодаря высокой концентрации компонентов.
Мнение эксперта
Всеволод Козловский
6 лет в ювелирном деле. Знает все о пробах и может определить подделку за 12 секунд
Драгметалл растворяется в царской водке благодаря тому, что азотная кислота окисляет соляную. Образуется особое соединение — атомарный хлор, который мгновенно реагирует с металлом, создавая сложную золотохлористоводородную кислоту. Часть драгметалла кристаллизуется, а другая часть — растворяется.
Стоит отметить, что протекание химической реакции зависит от того, в какой кислоте растворяется металл и какова ее концентрация.
Хлорка
Хлорка, широко применяемая в быту, — это водный раствор газообразного хлора, относящегося к группе галогенов. Для аффинажа хлорка, приобретенная в обычном магазине, не подойдет, т.к. ее концентрация слишком низка.
Концентрированный раствор хлора оказывает следующее действие: хлор распадается на соляную и хлорноватистую кислоты, вторая, в свою очередь, под действием солнечных лучей разлагается на соляную кислоту и кислород. Как и в реакции с царской водкой, выделяется атомарное вещество, которое с легкостью окисляет самородок.
Йод сам по себе — не растворимое в воде вещество. Растворяется его соединение с йодидом калия. Это лекарственный препарат под названием Люголь.
Золото растворяется в Люголе из-за того, что йод создает непрочные соединения — анионы. Но реакция проходит намного медленнее, нежели с кислотами, да и растворяется лишь верхний слой металла.
Какой способ подходит для домашних условий
Аффинаж золота (получение чистого металла) можно произвести и дома. Самый безопасный метод растворения — с помощью электрического тока.
Электролиз
Большая ванна наполняется соляной кислотой и хлорным золотом — реактивом, используемым для апробирования изделий и определения пробы. Его можно выделить при помощи царской водки, золота и аммиака или приобрести в готовом виде в магазинах ювелирного оборудования.
Реакция, называемая электрохимической, протекает за счет напряжения, поданного в ванну. В результате металл высокой пробы без примесей оседает на бортиках, а на дне ванны осадком выпадают оставшиеся компоненты.

Пошаговая инструкция по растворению золота
Растворение металла — трудоемкий процесс. Действенный способ — использование цинка. Он применяется химиками для выделения чистейшего металла высокой пробы.
Существует множество видео, на которых наглядно показана бурная реакция с цинком.
Необходимые материалы и инструменты
Требуются следующие инструменты:
- емкость для нагрева;
- большой пинцет;
- плита;
- огнеупорная колба;
- колпак с щелью;
- аппарат для плавления металлов.
- чистый тетраборат натрия (бура);
- азотная кислота концентрированная;
- соляная кислота средней концентрации;
- цинк.
Процесс растворения
Емкость для нагрева из огнеупорного стекла или фарфора с небольшим углублением в центре необходимо избавить от влаги и нагреть на плите. В углубление емкости добавить тетраборат натрия. Золотой лом опустить в емкость и нагреть. Убедившись, что лом покраснел, посыпать его тетраборатом.
Золото начинает плавиться, а значит, необходимо добавить к нему небольшие кусочки цинка.
Полученный раствор нужно прокипятить. После остывания добавить в колбу чистую прохладную воду, чтобы промыть осадок. Взболтать колбу для оседания хлопьев желтого оттенка, осторожно слить воду и промывать до того момента, пока вода в колбе не перестанет быть мутной.
Отделить осадок от воды с помощью марли, отжать лишнюю воду и присыпать тетраборатом натрия. Завязать марлю в тугой узел, поместить в колбу и нагревать до тления марли и расплавления тетрабората. На дне колбы должен образоваться золотой ком.
Как только слиток металла затвердеет, его нужно вытащить, очистить от остатков соединения буры с окисленными металлами, прокипятив пять минут в растворе азотной и соляной кислот. Должен получиться гладкий и блестящий золотой слиток.
Заключение
В целом, аффинаж золота — процесс не столь трудный, как кажется. Он доступен не только в условиях лаборатории, но и дома и не требует дорогостоящих химических веществ.
Растворить драгметалл и получить слиток без примесей можно, если следовать инструкциям и соблюдать технику безопасности.
Я желаю вам успехов в начинаниях по химии. Подписывайтесь на наши статьи, делитесь в соцсетях своими советами и результатами. До новых встреч!
Источник: zhazhdazolota.ru
Газообразное состояние вещества
Вещества в газообразном состоянии не обладают определенной формой и объемом, характеризуются малой плотностью, малой вязкостью и способны целиком заполнять любое пространство.
Изучение свойств газов привело к кинетической теории газов. Согласно кинетической теории газ представляют как совокупность атомов или молекул, находящихся в движении. Атомы или молекулы движутся по прямым линиям, сталкиваются друг с другом и со стенками сосуда, меняя свое направление по закону столкновения упругих тел, — угол падения равен углу отражения.
Молекулы движутся с различными скоростями (закон распределения скоростей Максвелла). Наибольшими средними скоростями обладают молекулы самых легких газов. Для водорода, например, средняя скорость при 0°C 1698 см/сек. Скорости молекул других простых и сложных газов составляют приблизительно 400—300 см/сек. Удары движущихся молекул о стенки сосуда обусловливают давление газов.
1. Идеальные газы
Если допустить, что между молекулами (атомами) газа нет притяжения и что можно пренебречь объемом самих молекул (атомов), то между объемом (V), занимаемым газом, температурой (T) и давлением (P) легко выводится следующее соотношение:
где R — универсальная газовая постоянная, обозначаемая начальной буквой фамилии французского ученого Реньо, а n — число киломолей газа, т. е. отношение массы газа в кг к его молекулярной массе. Для R в углеродной шкале принято значение (8314,31 ± 0,31) дж (кмоль · град).
Вышеуказанное уравнение называется уравнением идеальных газов Клапейрона — Менделеева.
2. Реальные газы
Говоря о реальных газах, нужно принимать во внимание притяжение между отдельными молекулами (атомами). Это притяжение обратно пропорционально квадрату объема, занимаемого газом. По предложению Ван-дер-Ваальса оно обозначается буквой a. Притяжение между молекулами (атомами) сжимает газы, следовательно, равноценно увеличению давления на газ, именно, на величину a/V 2 . Таким образом, давление реального газа в объеме V должно быть равно P + a/V 2 , где величина a зависит от природы газа.
Следует также учесть и то, что молекулы (атомы) реальных газов сами занимают некоторый объем, так что в действительности их движение происходит не в объеме V, а в объеме V—b. Приняв это во внимание, уравнение реальных газов можно написать в таком виде:
(P + a/V 2 )(V—b) = nRT.
Для точных расчетов необходимо при вычислении применять это уравнение, называемое уравнением Ван-дер-Ваальса.
| Таблица 1. Значения величин a и b для различных газов | |||
| Вещество | Формула | a | b |
| Водород | H2 | 0,00049 | 0,001188 |
| Азот | N2 | 0,00277 | 0,001763 |
| Кислород | O2 | 0,00265 | 0,001392 |
| Аргон | Ar | 0,00259 | 0,001348 |
| Хлор | Cl2 | 0,01063 | 0,002050 |
| Окись азота | NO | 0,00267 | 0,001245 |
| Окись углерода | CO | 0,0285 | 0,001723 |
| Двуокись углерода | CO2 | 0,00683 | 0,001813 |
Межмолекулярное взаимодействие. Силы взаимодействия между молекулами или атомами называются ван-дер-ваальсовскими. Они проявляются во всех агрегатных состояниях веществ. Чем ближе расстояние между молекулами, тем больше ван-дер-ваальсовское взаимодействие.
Так как среднее расстояние между молекулами для газообразных веществ наибольшее, то силы ван-дер-ваальса для них относительно малы. Чем большее сжатие испытывает газ, тем больше ван-дер-ваальсовские силы: при больших давлениях газы отступают от законов идеальных газов.
Естественно, что в жидкостях межмолекулярные взаимодействия более значительны, а в твердых телах — максимальны.
Приведение реального газа к состоянию идеального. Если известны поправочные коэффициенты уравнения Ван-дер-Ваальса а и b, то можно вычислить (PV)∞, т.е. при бесконечном разбавлении, когда коэффициентами а и b, вследствие их незначительной величины, можно пренебречь, реальные газы строго подчиняются законам идеальных газов. Этот прием называется приведением газа к состоянию идеального газа.
Чтобы найти приведенную плотность реального газа (D), нужно величину ее разделить на произведение (1 + а) (1 — b):
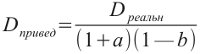
В табл. 2 сравнены приведенные молекулярные объемы с молекулярными объемами реальных газов.
Из табл. 2 видно, что приведенный молекулярный объем реальных газов равен 22,4135 м 3 /кмоль, т.е. объем киломоля реальных газов при нормальных условиях, приведенный к состоянию идеального газа, составляет 22,4135 м 3 /кмоль.
| Таблица 2. Сравнение молекулярных объемов реальных газов с приведенными молекулярными объемами | ||||
| Название | Формула | Молекулярная масса | Молекулярный объем реального газа, м 3 /кмоль | Приведенный молекулярный объем, м 3 /кмоль |
| Кислород | O2 | 31,9988 | 22,394 | 22,414 |
| Водород | H2 | 2,01594 | 22,426 | 22,413 |
| Азот | N2 | 28,0134 | 22,400 | 22,413 |
3. Переход газа в состояние жидкости
Уравнение идеальных газов устанавливает, что соотношение между объемом (V), давлением (P), числом молекул (n) и абсолютной температурой для всех газов одинаково и не зависит от их природы. Мы видели, что на практике это не так. Каждый реальный газ имеет свою индивидуальность, которая определяется различными значениями величин а и b.
Далее, если бы все газы подчинялись уравнению Клапейрона, то никаким давлением и никаким понижением температуры их нельзя было бы превратить в жидкость. Практика же показала, что все газы при определенных для каждого газа температуре и давлении превращаются в жидкость. Температура и давление, при которых данный газ превращается в жидкость, зависят от значений для этого газа величин a и b уравнения Ван-дер-Ваальса.
На рисунке изображены изотермы P, V для моля, т. е. зависимость изменения объема грамм-молекулы двуокиси углерода (CO2) от давления при разных температурах, вычисленные по формуле Ван-дер-Ваальса.
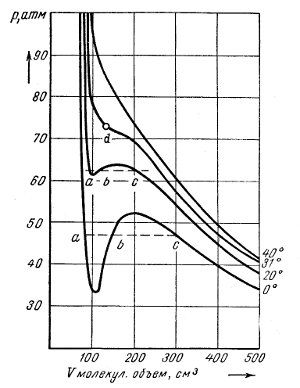
Изотерма при 0°C показывает, что с возрастанием давления объем сперва уменьшается, но до некоторого максимума давления; затем объем продолжает уменьшаться, но давление падает до некоторого минимума, так что для каждого данного давления мы имеем два объема. На практике состояния, выражаемые изломами кривой, неустойчивы — здесь газ превращается в жидкость.
Чтобы лучше уяснить себе, что происходит, представим, что грамм-молекула СО2 заключена в цилиндр, закрытый поршнем. Наложением грузов на поршень мы можем увеличивать или уменьшать давление. Опыт ведется при 0°C. Увеличивая давление на поршень с 35 атм приблизительно до 47 атм, мы наблюдаем уменьшение объема газа с 0,500 м 3 приблизительно до 0,300 м 3 . При этом объем газа изменяется согласно закону Бойля — Мариотта. Увеличив давление на бесконечно малую величину, мы увидим, что в цилиндре, кроме газа, появилась жидкость.
При дальнейшем движении поршня новые количества газа переходят в жидкое состояние, нагрузка же на поршень, т. е. давление, остается неизменным.
На рисунке это выражается пунктирной линией abc. По этой линии справа налево каждому движению поршня соответствует уменьшение объема газа и увеличение количества жидкости. В точке d газ исчез — он целиком превратился в жидкость. При дальнейшем увеличении давления на поршень объем жидкости, как показывает изотерма, меняется очень мало.
Итак, при температуре 0°C и давлении ~48 атм мы превращаем газ CO2 в систему, состоящую из газа и жидкости.
По рисунку мы видим, что при 20°C, чтобы превратить газ CO2 в жидкость, нужно поднять давление до 62 атм, причем участок кривой и пунктирная линия abc станут значительно меньше. При 31°C этот участок сжался до точки. Это значит, что при температуре 31°C и давлении в 73 атм нельзя сжать газ CO2 в жидкость, или различие между газом и жидкостью при этих условиях исчезает.
При температуре 40°C и выше газ также никаким давлением нельзя сжать в жидкость.
Температура, при которой газ никаким давлением нельзя сжать в жидкость, называется критической температурой. Давление, при котором кривая ас превращается в точку, называют критическим давлением. Критическая температура для каждого вещества имеет свое особое значение.
Газ при температуре выше критической условились называть газом, при температуре ниже критической — паром. Критическая температура есть мера стремления вещества принимать газообразное или жидкое состояние (табл. 3).
Для некоторых веществ, например гелия, водорода, кислорода и др. она очень низка. Поэтому прежде полагали, что эти вещества вообще не могут существовать в состоянии жидкости и называли их перманентными газами.
В настоящее время нет таких газов, которые невозможно было бы превратить в жидкое состояние.
| Таблица 3. Критическая температура, критическое давление и критическая плотность некоторых веществ | ||||
| Название веществ | Формула | Критическая температура, °С | Критическое давление, атм | Критическая плотность |
| Гелий | He | —267,9 | 2,26 | 0,06 |
| Водород | H2 | —239,9 | 12,8 | 0,031 |
| Неон | Ne | —228,7 | 26,9 | 0,4 |
| Азот | N2 | —147,0 | 33,5 | 0,311 |
| Аргон | Ar | —122,0 | 48 | 0,53 |
| Кислород | O2 | —118,4 | 50,1 | 0,430 |
| Окись азота | NO | —93 | 64 | 0,52 |
| Криптон | Kr | —63,8 | 54,3 | 0,78 |
| Хлористый водород | HCl | +51,4 | 81,5 | 0,42 |
| Аммиак | NH3 | +132,3 | 111,3 | 0,24 |
| Хлор | Cl2 | +144 | 76,1 | 0,573 |
| Двуокись серы | SO2 | +157,2 | 77,7 | 0,52 |
| Бром | Br2 | +311 | 102 | — |
| Уксусная кислота | C2H4O2 | +322 | 57 | 0,171 |
| Вода | H2O | +374,2 | 218,3 | 0,056 |
| Иод | I2 | +553 | — | — |
| Ртуть | Hg | >1550 | >200 | 4—5 |
Вернуться на главную страницу
Источник: proznania.ru
Агрегатные состояния веществ

1. Основные положения, при помощи которых объясняется различие строения веществ в твердом, жидком и газообразном состоянии
Дети назовите вещество которое находится в трех агрегатных состояниях. Верно это вода. Которая может находиться в жидком, твёрдом и газообразном состоянии. Вода это жидкое состояние, пар газообразное состояние и лёд — твёрдое состояние. Скажите а какие положения веществ отличают одно состояние от другого.
Это расположение частиц, движение частиц и взаимодействие частиц.
2. Расположение частиц в твердом состоянии, жидком и газообразном
И так, рассмотрим отличие одного состояния веществ от другого. В твёрдом состоянии частицы располагаются в строгом порядке, образуя кристалл. Частицы не имеют строгого положения в жидком состоянии. В газообразном состоянии нет строгого порядка.
3. Движение частиц в твердом, жидком и газообразном состоянии
Частицы в твердых телах совершают колебательное движение. Подобно маятнику часов. В жидкостях молекулы совершают бестолковое движение. В газообразном состоянии частицы движутся хаотично, беспорядочно, с очень большой скоростью. Она равна скорости пули из ружья.
Примеры: при 20 градусах по Цельсию скорость молекулы водорода — 2000 м/с, а кислорода 1600 м/с, азота 600 м/с.
4. Взаимодействие частиц в твердом, жидком и газообразном состоянии
В твёрдом состоянии частицы взаимодействуют очень сильно между собой. Так как между частицами промежутки меньше размера одной частицы. В жидком состоянии взаимодействие слабее. Между частицами промежутки увеличиваются и равны размеру одной частицы. В газообразном состоянии взаимодействие частиц самое слабое.
В промежутках между частицами можно поместить до десяти таких частиц.
5. Форма и объем которую принимают вещества в твердом, жидком и газообразном состоянии
Но кроме трёх положений агрегатные состояния характеризуются объемом и формой. В твёрдом состоянии форма неизменная. Жидкость принимает форму сосуда. И газы принимают форму сосуда. Объём твердых тел неизменный. Для изменения объема твердого тела, необходимо приложить огромные усилия.
Объем жидкости изменить нельзя. Пример: возьмем свинцовый шар и заполнили его водой. Запаяли шар. Стали ударять молотом по нему, пытаясь уменьшить объем. Шар лопнул. Вода вылилась. Возникают силы отталкивания. Которые не дают возможности уменьшить объем.
А в газах занимает наибольший, предоставленный объем. Примеры: возьмем медные опилки и поместим в мензурку большого объема. Нальем азотной кислоты. Закроем мензурку наполовину. Образуется бурый дым, который заполняет половину мензурки.
Передвинем крышку вверх, до полного объема. Бурый дым заполняет все пространство. Это доказывает, что газы занимают наибольший предоставленный объем.
Источник: fizkonspekt.ru