Туннельные микроскопы обеспечивают увеличение в 100 млн раз. Это позволяет измерять размеры атомов с очень большой точностью. Так, диаметр атома углерода оказался равным 1,4·10 -8 см. Такой же порядок имеют и размеры других атомов.
Размеры атомов и молекул, найденные другими методами, оказываются примерно такими же.
Эти размеры так малы, что их невозможно себе представить. Что вам может сказать, например, число 2,3·10 -8 см — размер молекулы водорода? В таких случаях прибегают к помощи сравнений. Если, например, вашу голову увеличить до размеров средней звезды типа Солнца, то молекула при этом увеличится до размеров головы.
А вот еще сравнение. Если представить себе, что все размеры в мире возросли в 10 8 раз, то молекула водорода будет выглядеть как шарик диаметром всего в 2,3 см (средних размеров слива), а рост человека стал бы равным 170 000 км, размер мухи — 10 000 км, толщина волоса — 10км, размер красного кровяного тельца (эритроцита) — 700 м.
Число молекул
При столь малых размерах молекул число их в любом макроскопическом теле чрезвычайно велико. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объемом 1 см 3 . Диаметр молекулы воды равен приблизительно 3·10 -8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объем (3·10 -8 см) 3 , можно найти число молекул в капле, разделив объем капли (1 см 3 ) на объем, приходящийся на одну молекулу:
Молекулы
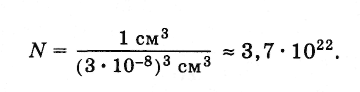
Представьте себе, что поверхность земного шара твердая и гладкая. На всей поверхности вплотную друг к другу стоят люди. Число людей при этом будет чуть меньше числа молекул в 1 см 3 воздуха при нормальном атмосферном давлении и температуре 0 °С.
Надо помнить основные положения молекулярно-кинетической теории. Атомы имеют размеры порядка 10 -8 см. Изображения атомов, полученные с помощью туннельного микроскопа, не оставляют никаких сомнений в их существовании,
§ 2.2. Масса молекул. Постоянная Авогадро
Массы молекул очень малы, если выражать их в граммах или килограммах, а число молекул в макроскопических телах огромно. С очень маленькими и очень большими числами иметь дело неудобно. Ученые нашли довольно простой способ избежать этого неудобства и характеризовать массы молекул и их число вполне обозримыми числами, не выходящими далеко за пределы сотни. Сейчас вы познакомитесь с тем, как это делается.
Масса молекулы воды
В предыдущем параграфе мы выяснили, что в 1 г воды содержится 3,7·10 22 молекул. Следовательно, масса одной молекулы равна:
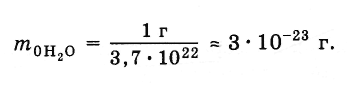
Массы такого же порядка имеют и молекулы других веществ, исключая огромные молекулы органических соединений. Например, масса молекулы гемоглобина превышает массу молекулы воды в несколько десятков тысяч раз.
Относительная молекулярная масса
Так как массы молекул очень малы, удобно использовать не абсолютные значения масс, а относительные. По международному соглашению, принятому в 1961 г., массы всех молекул сравнивают с 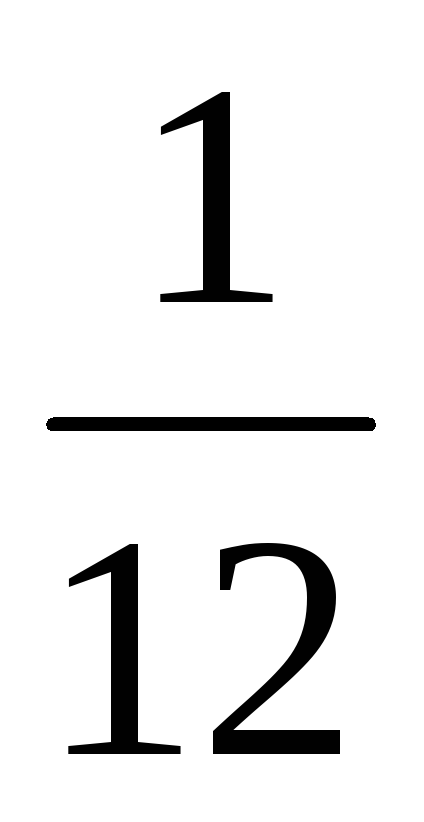
Длина свободного пробега
Главная причина выбора углеродной шкалы атомных масс состоит в том, что углерод входит в огромное число различных органических соединений. Этот выбор позволяет очень точно сравнивать массы атомов тяжелых элементов с массой атома углерода. Множитель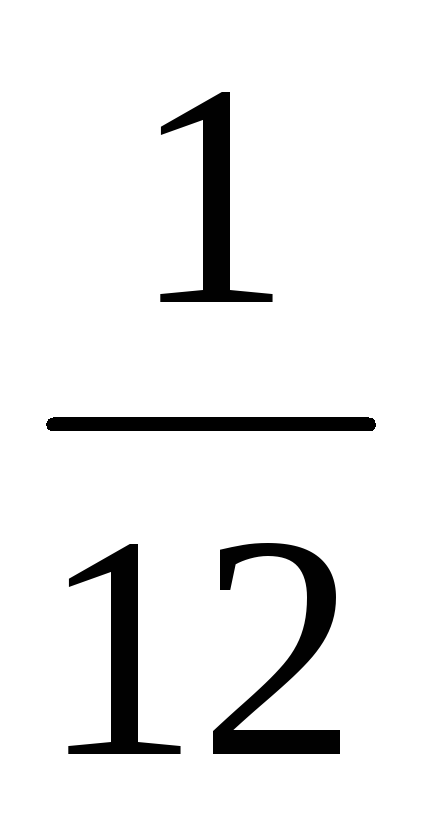 введен для того, чтобы относительные массы атомов были близки к целым числам. Относительная масса атома углерода точно равна 12, а атома водорода примерно равна единице.
введен для того, чтобы относительные массы атомов были близки к целым числам. Относительная масса атома углерода точно равна 12, а атома водорода примерно равна единице.
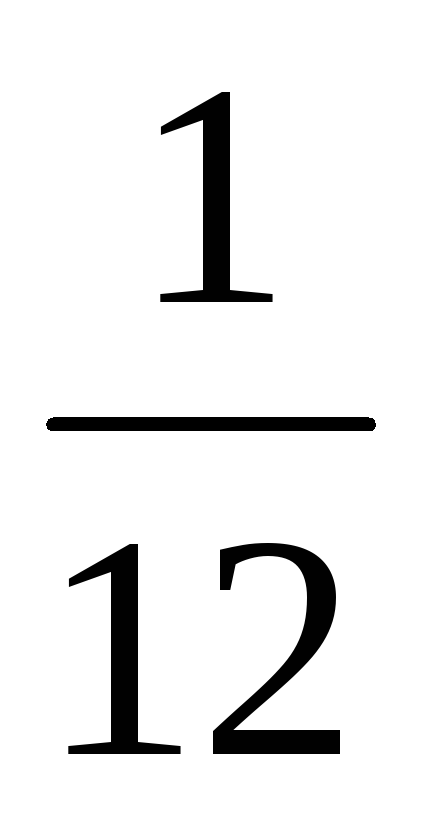
* Точнее, с массы атома наиболее распространенного изотопа углерода-12.

Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) данного вещества к массы атома углерода т0С:

(2.2.1)
Относительные атомные массы всех химических элементов точно измерены. Складывая относительные атомные массы, можно вычислить относительную молекулярную массу. Например, относительная молекулярная масса воды Н2О приближенно равна 18, так как относительные атомные массы водорода и кислорода примерно равны 1 и 16:2-1 + 16=18.
Источник: studfile.net
Зная число авогадро определите объем и диаметр атома золота?
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
10 класс
Для характеристики микроскопических состояний системы необходимо ввести определённые микроскопические параметры вещества. В § 37. «Основные положения молекулярно-кинетической теории и их опытные обоснования» мы выяснили, что в 1 г воды содержится примерно 3,7 ∙ 10 22 молекул. Следовательно, масса одной молекулы m0 воды равна

Массы такого же порядка имеют и молекулы других веществ, исключая огромные молекулы органических соединений. Например, масса молекулы гемоглобина превышает массу молекулы воды в несколько десятков тысяч раз.
Относительная молекулярная масса.
Так как массы молекул очень малы, удобно использовать не абсолютные значения масс, а относительные. По международному соглашению, принятому в 1961 г., массы всех молекул сравнивают с 1 / 12 массы атома углерода 1 (так называемая углеродная шкала атомных масс).
1 Точнее, с 1 / 12 массы атома наиболее распространённого изотопа углерода 12 6 C .
Главная причина выбора такой шкалы состоит в том, что углерод входит в огромное число различных органических соединений. Этот выбор позволяет очень точно сравнивать массы атомов тяжёлых элементов с массой атома углерода. Множитель 1 / 12 введён для того, чтобы относительные массы атомов были близки к целым числам. Относительная масса атома углерода точно равна 12, а атома водорода — примерно 1.
Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1 / 12 массы атома углерода moc.

Количество вещества.
Чем больше атомов или молекул в макроскопическом теле, тем, очевидно, больше вещества содержится в нём. Число молекул в макроскопических телах огромно, поэтому удобно указывать не абсолютное число атомов, а относительное. Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г.
Относительное число атомов или молекул в теле характеризуется физической величиной, называемой количеством вещества.
Количеством вещества ѵ называют отношение числа молекул N в данном теле к числу атомов NA в 12 г углерода.

Зная количество вещества ѵ и число NA, можно с помощью формулы (2) определить число молекул N в веществе. Количество вещества выражают в молях. Моль — это количество вещества, содержащего столько же молекул, сколько атомов содержится в углероде массой 12 г. Если количество вещества равно, например, 2,5 моль, то это означает, что число молекул в теле в 2,5 раза превышает число атомов в 12 г углерода, т. е. N = 2,5NA.
Постоянная Авогадро.
Число молекул или атомов в одном моле вещества называют постоянной Авогадро в честь итальянского учёного Амедео Авогадро (1776—1856). Согласно определению моля, постоянная Авогадро одинакова для всех веществ. Она равна, в частности, числу атомов в одном моле углерода, т. е. в 12 г углерода. По современным данным масса атома углерода moc = 1,995 ∙ 10 -23 г. Отсюда постоянная Авогадро равна

Наименование моль -1 указывает, что NA — число атомов любого вещества, взятого в количестве одного моля.
К настоящему времени разработаны методы определения постоянной Авогадро, не связанные с определением масс атомов. Все они приводят к одним и тем же результатам. Постоянная Авогадро играет важнейшую роль во всей молекулярной физике и является универсальной физической постоянной. Огромная величина постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры.
Молярная масса.
Наряду с относительной молекулярной массой Mr, в физике и химии широко используется понятие молярной массы М.
Молярной массой называют массу вещества, взятого в количестве одного моля.
Согласно этому определению, молярная масса M равна произведению массы молекулы m0 па постоянную Авогадро NA.

Молярная масса связана с относительной молекулярной массой. Подставив в формулу (4) выражения m0 из (1) и NA из (3), получим:

Масса m произвольного количества вещества ѵ равна произведению массы молекулы этого вещества на число молекул в этом теле:

Для определения числа молекул N в теле в зависимости от его массы m и молярной массы M можно записать формулу:

Вопросы:
а) относительной молекулярной массой вещества;
б) количеством вещества;
в) молярной массой?
2. В чём состоит физический смысл постоянной Авогадро?
3. Как связаны между собой:
а) молярная масса и относительная молекулярная масса;
б) масса произвольного количества вещества и молярная масса?
4. Как можно определить массу одной молекулы, зная молярную массу?
Упражнения:
1. Кусочек парафина объёмом 1 мм 3 , брошенный в горячую воду, расплавился и образовал плёнку, площадь поверхности которой равна 1 м 2 . Оцените диаметр молекулы парафина, полагая, что толщина плёнки равна диаметру молекулы.
2. Расстояние между центрами соседних атомов золота равно 2,9 ∙ 10 -10 м. Сколько слоёв атомов содержится в листочке золота толщиной 0,1 мкм?
3. Какое количество вещества составляет 5,418 ∙ 10 26 молекул?
4. Кусок алюминия и кусок железа содержат одинаковое количество вещества. Чему равна масса куска алюминия, если масса куска железа — 2 кг?
5. На изделие, площадь поверхности которого равна 20 см 2 , нанесён слой серебра толщиной 1 мкм. Сколько атомов серебра содержится в покрытии?
Источник: xn—-7sbbfb7a7aej.xn--p1ai