Когда мы говорим о химии, мы подразумеваем строительные блоки Вселенной. Все элементы действуют как кирпичи конструктора Лего, присоединяясь друг к другу, пока не создадут нечто большее, например, металлы, воду, химические соединения и даже живых существ. Иногда они не стыкуются и разваливаются или взрываются, ухудшая свои основные формы. Именно эти связи и реакции составляют Вселенную, какой мы ее знаем и видим.
Хотя все вещи на нашей планете состоят из отдельных атомов и элементов, различия между объектами и видами заключаются в способности элементов сочетаться с другими элементами. Как вы, наверное, уже знаете, валентность элемента измеряет его способность сочетаться с другими, а число электронов внутри внешней оболочки элемента называется валентностью.
Как определить валентность элемента
Для этого существует несколько методов. Первый и самый простой способ — это просто обратиться к периодической таблице Менделеева. Элементы распределены по группам, их 8. В каждой группе они имеют одинаковую валентность. Например, все элементы в группе 8 имеют восемь электронов (высокая стабильность).
Определи валентность, если вещество состоит из трех элементов #shorts
Второй метод — посмотреть на общее количество электронов, а затем вычислить их число по атомному номеру. Как только вы узнаете количество электронов, вы можете легко вычислить валентность. Все атомы, кроме водорода, имеют два электрона в первой электронной оболочке и до восьми в каждой последующей. Например, атомный номер хлора равен 17, что делает конфигурацию электронов равной:
То есть валентность хлора равна 7. Кислород имеет восемь электронов, два в первой оболочке и шесть во внешних оболочках, давая ему число 2. Вы можете рассчитать многоэлементные молекулы таким же образом. Например, чтобы определить тетраоксид фосфора, вы должны умножить атомы кислорода (валентность 2) и вычесть из валентности фосфора 5, получив число 3.
Ознакомьтесь с электронной конфигурацией каждого уровня оболочки. Каждый атом имеет два электрона на своей внутренней оболочке и до восьми электронов на каждой оболочке. Например, поскольку литий имеет три электрона, он будет иметь два внутри и один электрон на своей внешней оболочке.

Правило октета
При определении атома или молекулы (для которой вы не можете использовать периодическую таблицу), химики используют правило октета. Согласно этому правилу, атомы и химические вещества объединяются таким образом, чтобы образовать восемь электронов во внешней оболочке любого соединения, которое они образуют. Когда атом или молекула имеет от одного до четырех электронов в своей внешней оболочке, он имеет положительную валентность, то есть он жертвует свои свободные электроны. Когда число электронов составляет:
— вы определяете его способности путем вычитания электронного числа из 8. Это потому, что атом или молекула легче принимает электроны для достижения стабильности.
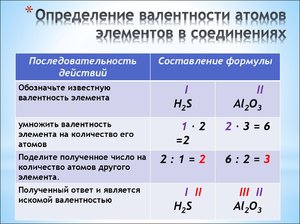
Определение по таблице Менделеева
Ученые устроили все элементы в диаграмму, называемую периодической таблицей, и во многих случаях вы можете определить валентность, взглянув на график. Например, все металлы в колонке 1, включая водород и литий, имеют +1, тогда как все те, что указаны в колонке 17, включая фтор и хлор, имеют -1. Благородные газы в колонке 18 имеют 0 и являются инертными.
С помощью этого метода вы не можете найти валентность меди, золота или железа, потому что у них много активных электронных оболочек. Это справедливо для всех переходных металлов в колонках 3–10, более тяжелых элементов в колонках с 11 по 14, лантаноидов (элементы 57–71) и актинидов (элементы 89–103).

Определение зависимости от химических формул
Вы можете определить переходный элемент или радикал в конкретном соединении, заметив, как он сочетается с элементами известной валентности. Эта стратегия основана на правиле октета, которое говорит нам о том, что элементы и радикалы объединяются, чтобы создать стабильную внешнюю оболочку из восьми электронов.
В качестве простых иллюстраций этой стратегии обратите внимание, что натрий (Na), имеющий +1, легко сочетается с хлором (Cl), который имеет -1, с образованием хлорида натрия (NaCl) или поваренной соли. Это пример ионной реакции, в которой электрон пожертвован одним атомом и принят другим. Однако для соединения с серой (S) требуется два атома натрия с образованием сульфида натрия (Na2S), сильнощелочной соли, используемой в целлюлозной промышленности.
Чтобы применить эту стратегию к более сложным молекулам, важно сначала понять, что элементы иногда объединяются с образованием реактивных радикалов, которые еще не достигли стабильности внешней оболочки. Примером является сульфатный радикал (SO4). Это тетраэдрическая молекула, в которой атом серы разделяет электроны с четырьмя атомами кислорода в так называемой ковалентной связи. В таком соединении вы не можете получить валентность атомов в радикале, если посмотреть на формулу. Поскольку для образования этого соединения требуется два атома натрия, валентность серы должна быть -2.
Однако вы можете определить радикал с помощью ионных соединений, которые он образует. Например, сульфатный радикал объединяется ионно с водородом, образуя серную кислоту (H2SO4). Эта молекула содержит два атома водорода, каждая из которых имеет +1, поэтому в этом случае валентность радикала равна -2. Как только вы определили радикал, вы можете использовать ее для вычисления молекул, с которыми он объединяется.
Например, железо (Fe) представляет собой переходный металл, который может проявлять множественные валентности. Когда он сочетается с сульфатным радикалом с образованием сульфата железа, FeSO4, он должен иметь +2 поскольку сульфатный радикал, определяется по связи, которую он образует с водородом.
Видео
Из этого видео вы узнаете, как определять валентность элементов по формулам.
Источник: liveposts.ru
Валентность золота
Золото расположено в шестом периоде I группе побочной (В) подгруппе Периодической таблицы. Металл. Обозначение – Au. Порядковый номер – 79.
Золото представляет собой металл желтого цвета с гранецентрированной кубической решеткой. Золото характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 19,3 г/см 3 . Температура плавления 1064,4 o С, кипения 2880 o С.
Валентность золота в соединениях
Золото – семьдесят девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в шестом периоде в IВ группе. В ядре атома золота содержится 79 протонов и 117 нейтронов (массовое число равно 197). В атоме золота есть шесть энергетических уровней, на которых находятся 79 электронов (рис.
1).
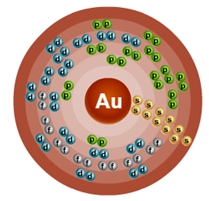
Рис. 1. Строение атома золота.
Электронная формула атома золота в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
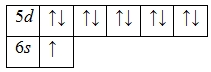
Наличие одного неспаренного электрона свидетельствует о том, что золото проявляет валентность I в своих соединениях (Au2O, AuNO3, AuCl, Au2S и т.д.).
Известно, что для золота также характерна валентность II (AuO, AuF2).
Примеры решения задач
| Задание | Золото 585 пробы содержит 41,5% меди. Сколько граммов чистого золота содержит кольцо этой пробы, имеющее массу 2,8 г? |
| Решение | Найдем массовую долю золота в 585 пробе: |
ω(Au) = 100% — ω(Cu) = 100% — 41,5% = 58,5% = 0,585.
Вычислим массу чистого золота, которая содержится в кольце:
m(Au) = 2,8 × 0,585 = 1,638 г.
| Задание | Определите количество золота и серебра, которое содержится в обручальном кольце 585 пробы массой 3,75 г. |
| Решение | 585 проба означает, что в изделии содержится 58,5% (0,585) золота. Найдем массу золота в сплаве: |
m(Au) = 3,75 × 0,585 = 2,19 г.
Тогда масса серебра составит:
m(Ag) = mring — m(Au) = 3,75 -2,19 = 1,56 г.
Найдем количество моль каждого металла (молярная масса золота равна 196 г/моль, серебра – 108 г/моль):
n(Au) = 2,19 / 196 = 0,01 моль;
n (Ag) = 1,56 / 108 = 0,014 моль.
Источник: ru.solverbook.com
Чему равна валентность золота

Опубликовано 10.06.2017 по предмету Химия от Гость >> Оцени ответ


- Алгебра

- Математика

- Русский язык

- Українська мова

- Информатика

- Геометрия

- Химия

- Физика

- Экономика

- Право

- Английский язык

- География

- Биология

- Другие предметы

- Обществознание

- История

- Литература

- Українська література

- Беларуская мова

- Қазақ тiлi

Показать ещё
Источник: www.shkolniku.com