Предупреждение! Данная статья носит информационный, научно-популярный и юмористическо-развлекательный характер! Увы, но сейчас создавать из свинца золото хотя и можно, но этот процесс является очень емким и приводит к незначительным результатам.
Вводная информация
В гробнице египетского города Фивы в начале прошлого века нашли папирус. В нем было 111 рецептов, среди которых оказались и те, что рассматривали возможность получения серебра и золота. Но, увы, это было направлено на создание подделок или покрытие драгоценными металлами других, менее дорогих, объектов.
Вам будет интересно: Нафтеновая кислота — особенности, свойства, применение и формула
Тем не менее этот документ показал, что алхимия даже в древние века захватывала умы людей, жаждущих легкой наживы. Распространяясь через египтян и греков, она смогла постепенно захватить всю Европу. Наибольший практический рассвет пришелся на средневековье. Тогда алхимией интересовались не только ученые, но и государственные и церковные чины.
Свинец / Металлы и технологии
Так, практически при каждом императорском дворце можно было найти «специализированных» людей, которые должны были получить золото, чтобы улучшить состояние казны. Широкое распространение приобрело мнение, что это можно сделать с помощью философского камня.
Чего смогли добиться в Средневековье
Вам будет интересно: Бараньи рога: значение и символика

Железо, золото, свинец и ртуть считались близкими металлами — что один из них можно превращать в другой. Например, взять рецепт Луллия. Он предлагал обратить взор на свинец и обжигать его до тех пор, пока не будет получен оксид данного металла. Затем необходимо было нагреть получившуюся субстанцию с кислым спиртом винограда на песчаной бане.
Полученная от выпаривания камедь перегонялась. То, что оставалось, необходимо было растереть на камне и прикоснуться к нему раскаленным углем. Затем нужно было еще раз перегнать субстанцию и получалась уксусно-свинцовая соль.
В чем ценность этого соединения? По сути, описывается обычная химическая реакция, а именно – перегонка уксусно-свинцовое соли. Это соединение действительно могло творить чудеса. А именно – восстанавливать золото из растворов его солей.
Дальнейшее развитие
Вам будет интересно: Понятие об ускорении. Формулы ускорения при равноускоренном прямолинейном движении и перемещении по окружности. Ускорение свободного падения

Алхимия процветала до середины семнадцатого века. Из свинца золото, равно как и с других материалов, получить не удалось. Хотя довольно неплохо была изучена химия. Высокопоставленные лица того времени подобные увлечения поддерживали, что позитивно сказывалось на развитии прикладных исследований. Более того, многие правители, короли и императоры сами были алхимиками.
Алхимики превращали свинец в золото. В автобизнесе свинца нет — так что мы взяли чугун и гальванику!
И многие осуществляемые ними превращения не являются обманом, просто драгоценный металл содержался в исходном веществе и его просто выделили.
Но со временем количество людей, которые верили бы в алхимию, начало уменьшаться. Немало этому поспособствовал тот факт, что в качестве панацеи от всех болезней был объявлен философский камень. Когда это на практике не оправдалось, в алхимии начали сомневаться. Хотя разочаровались не до конца. Многие опыты все же позволяли получать золото.
Правда связано это было с тем, что в некоторых природных рудах этот драгоценный металл содержится в определенном количестве. Благодаря различным химическим реакциям его получалось очистить и дистиллировать.
Первые «успехи»
Алхимик Гобмерг смог получить золото, расплавляя серебро с сурьмяной рудой. Драгоценного металла на выходе оказалось не много. Но вот алхимик уверовал, что ему открылся секрет превращения металлов. Правда, при уже точном анализе просто оказалось, что определенный процент золота был с самого начала.
Аптекарь Каппель в 1783 году смог добиться подобного результата – он получил драгоценный металл из серебра, использовав мышьяк. Возможно это исключительно благодаря осаждению иодида свинца. А золото, как, наверное, догадались, было уже в руде.
С помощью науки

После того как открыли атомы и реакции превращения, на смену алхимикам пришли физики-ядерщики. Основу в этом случае заложил Демпстер Артур Джеффри. Изучая масс-спектрографические данные драгоценного металла, ученый пришел к выводу, что есть только один стабильный изотоп – с массовым числом 197. Поэтому, если хочется сделать из свинца золото (или превратить другой подобный материал), то необходимо обеспечить протекание необходимой ядерной реакции. Нужно, чтобы она давала на выходе именно изотоп 197.
В 1940 году данный вопрос начал изучаться более подробно. Проводились опыты по бомбардировке быстрыми нейтронами соседних элементов таблицы Менделеева. Таковыми являются платина и ртуть. Через год было сообщено – при использовании второго материала удалось добиться успеха. Было получено золото. Но его изотопы имели массовые числа 198, 199 и 200.
Золото ученые получили, но существовало оно весьма краткий промежуток времени. Хотя из экспериментов был сделан вывод, что самый лучший исходный материал – это ртуть. Получить золото из свинца тоже теоретически возможно, но реализовать это значительно сложнее.
Проработка ртути

Наиболее подходящими для манипуляций является материал с массовым числом 196 и 199. Так, из 100 грамм ртути можно рассчитывать примерно на 35 мкг золота. Несложно догадаться, что из-за дороговизны ядерных превращений цена получилась намного больше рыночной. Поэтому популярности данный метод не приобрел.
Получение стабильного изотопа (золото-197) теоретически возможно в промышленном масштабе из ртути-197. Вот только такого химического элемента в природе не существует. Хотя можно обратить внимание еще на таллий-201. Правда здесь проблема иного характера – у этого элемента нет альфа-распада. Поэтому, более актуальным является получение все же изотопа ртути-197.
Получить его можно из таллия-197 или свинца-197. Казалось бы, на первый взгляд, второй вариант значительно легче. Но и таким образом из свинца золото получить сложнее, ведь эти материалы в природе не существуют и должны быть синтезированы посредством ядерных превращений. То есть делать драгоценный металл можно, только это очень сложно и затратно. А так рассмотренный вариант – это самый реальный ответ на то, как из свинца сделать золото.
Холодный ядерный синтез

Сейчас золото из свинца в домашних условиях не сделать – слишком наукоемкий и затратный этот процесс. А связано это с тем, что необходимо проведение горячего ядерного синтеза. То есть необходимо достигать значительных температур, что является само по себе весьма затратным с энергетической точки зрения.
Если же удастся запустить холодный ядерный синтез, то получится возможность получить драгоценный металл с относительно небольшими затратами. Правда, в таком случае актуальным является вопрос о том, как остановить его/держать под контролем.
К тому же, получая золото в огромных количествах, человечество может перестать его ценить. Ведь ценен этот металл не только благодаря своим качествам и характеристикам, но еще и тем, что он существует в ограниченном количестве. И еще с холодным ядерным синтезом необходимо учитывать, что преобразование элементов таблицы Менделеева можно осуществлять только в одну сторону – справа налево. Вот в этом случае свинец очень хорошо подходит для его превращения в золото. Но это, увы, пока в теории.
Заключение

Часто спрашивают, что тяжелее золото или свинец. Это неправильно заданный вопрос. Ведь килограмм всегда будет представлять собой один и тот же вес. Более актуальным и правильным является вопрос об объеме. Или говоря более научно – плотности вещества. В этом плане золото занимает лидирующие позиции. Среди распространенных и известных материалов оно № 1 по соотношению объем-вес.
Ближайший материал, который наступает ему на пятки, – это вольфрам. Кстати, именно из него и подделывают чаще всего рассматриваемый драгоценный металл. Это связано с тем, что по ряду характеристик эти металлы отличаются на проценты.
Различные материалы, которые рассматриваются как очередники на превращение в золото, могут иметь кратную разность по характеристикам объем/вес. Кстати, благодаря этому многие не совсем ориентируются в том, насколько сложно переносить этот драгоценный ресурс. Например, взрослому мужчине очень сложно, а то и невозможно, поднять слиток золота, размером в среднестатистический школьный ранец.
Источник: 1ku.ru
Извлечение благородных металлов из свинца

Золото и серебро, растворенные в свинце, при добавлении цинка образуют твердые интерметаллические соединения, всплывающие на поверхность ванны в виде твердой рыхлой корки — серебристой цинковой пены.
Из диаграммы состояния Au—Zn известны соединения AuZn,
Au 3Zn5, AuZn3 с температурами плавления соответственно 725, 644 и 475° С, а из системы Ag—Zn—Ag2Zn3 и Ag2Zn5, плавящиеся при 665 и 636° С. Медь также реагирует с цинком, а мышьяк затрудняет отделение пены, эти примеси должны быть предварительно удалены.
Цинк растворим в свинце ограниченно, избыток его всплывает в виде раствора, насыщенного свинцом. Пена — сложный продукт, содержащий серебро, золото, свинец и цинк. Для обогащения благородными металлами и экономии цинка ее пускают в оборот. Первой добавкой при 500° С служат бедные съемы с предыдущего котла. После полного их расплавления свинец перемешивают 20—30 мин, охлаждают до 450—480° С и снимают пену.
Вторую и последующие присадки цинка дают в соответствии с анализами металла на серебро и золото. Перед каждым очередным вмешиванием котел разогревают до 450—480, а перед съемом охлаждают до 340—350° С. Для удаления серебра до содержания 3 г/т достаточно трех добавок цинка, общий расход которого около 1% от массы свинца.
В богатую пену переходит до 70% благородных металлов и ее направляют на переработку для их извлечения. Пена содержит 5—10% (в сумме золота и серебра), 25% цинка, остальное свинец. Еще не застывшие мягкие съемы рыхлят вручную и направляют на дистилляцию для отгонки цинка и получения серебристого свинца.
Дистилляцию проводят в круглых трехэлектродных печах мощностью 0,5 МВт (рис.). Графитовые электроды погружают в шлак, покрывающий ванну сплава, его искусственно наводят, сплавляя соду, песок и известь, чтобы получить силикаты натрия и кальция. Пену загружают механическим питателем, добавляя в нее 2—3% мелкого кокса.
При температуре около 1250° С отгоняется до 90% цинка, более половины его собирают в конденсаторе с разбрызгивающей вертушкой в виде жидкого металла, а остальной улавливают с пылью. Остаток от дистилляции— серебристый свинец выпускают через сифон, в нем не более 2% цинка. Жидкий цинк из конденсатора отливают в чушки и возвращают на рафинирование.
При температуре плавки цинк и свинец смешиваются во всех соотношениях. Давление пара над их раствором равно сумме давлений паров компонентов
Проверь хорошо ли Вы знаете науки
Ты получил <> снаружи >
По закону Рауля, для идеальных жидкостей это справедливо, а для реальных в зависимости от знака теплоты растворения наблюдаются положительные либо отрицательные отклонения, превращающие линию суммарного давления
Рис. Схема печи для дистилляции цинковой пены:
1 — электроды; 2 — загрузочный бункер; 3— печь; 4 —роторы, разбрызгивающие жидкий цинк; 5 —газоход; 6 — конденсатор
в выпуклую или вогнутую кривую (рис. 2). На диаграмме системы Pb — Zn показана зависимость температуры кипения от состава сплава; с уменьшением концентрации цинка она повышается. Практически при температуре 1250° С удается понизить концентрацию цинка в серебристом свинце только до 2%, а в конденсате получить не менее 10% свинца; однако это не существенно: цинк возвращают на рафинирование свинца.
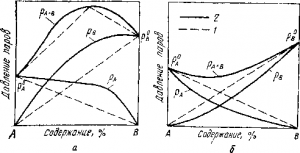
Рис. 2 . Зависимость давления паров от состава раствора:
а — с максимумом: б — с минимумом; 1 — по закону Рауля для идеальных растворов: 2 — варианты отклонений в реальных растворах
Серебристый свинец купелируют — окисляют его до глета, а серебро и золото остаются в ванне печи в сплаве, называемом металлом доре, от французского d’ore — золото.
Ванну купеляционной печи — купель — выкладывают из магнезитового кирпича в железном кожухе и устанавливают на тележке, стенки защищают кессонами (рис. 3 ). Жидкий глет, всплывающий на поверхность сплава, постепенно выпускают, а в ванну загружают новые порции серебристого свинца, накапливая в ней золото и серебро.
Когда ванна наполнится сплавом, окончательно окисляют остаток свинца. Образуемые при этом небольшие количества глета впитываются в купель. Металл до ре разливают в изложницы и отправляют на аффинажные заводы для разделения на золото и серебро. Избыток цинка из рафинированного свинца необходимо удалить использовать. Концентрация его достигает 0,7%; а мас са в суточном количестве металла при средней современной мощ ности предприятий измеряется десятками тонн.
На многих заводах от цинка избавляются щелочным способом, подобно олову, мышьяку и сурьме, селитры не требуется он хорошо окисляется щелочью по реакции:
протекающей энергично с выделением тепла, для отвода избытка которого реактор иногда приходится снабжать водяной ру башкой.
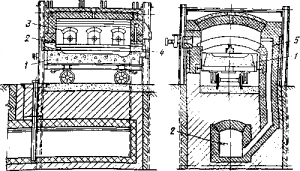
Рис. 3 . Купеляционная печь:
1 — ванна (купель) на тележке; 2 — подача воздуха; 3 — форсуночные окна; 4 — выпуск жидкого глета; 5 — дымоход
Рафинирование длится 7—10 ч, на 1т цинка расходуют 1 т NaOH и 0,75 т NaCl. Отработанный плав гранулируют, гидроокись цинка образует суспензию, которую после отделения металлических корольков фильтруют. Раствор выпаривают до суха, щелочь возвращают в голову процесса, а гидроокись цинка прокаливают и продают для изготовления красок. Затраченный цинк при этом возвращается на 95%, но в виде окиси.
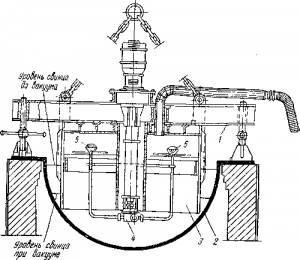
Рис. 4 . Аппарат для вакуумного обесцинкования свинца:
1 — опорная рама; 2 — котел; 3 —стальной стакан; 4 — насос для свинца; 6 — разбрызгиватели свинца с отбойными дисками
Дистилляция в вакууме перед щелочным рафинированием позволяет возвратить только 80% цинка, но в виде сплава, который снова пригоден для рафинирования свинца. Предназначенный для этого аппарат (рис. 4) переносят краном и устанавливают на обычном котле. На раме его укреплен стальной колокол с охлаждаемым водой днищем, соединенный с вакуум-насосом. По оси аппарата проходит стальная труба, в ней — вал свинцового насоса, от которого вверх направлены трубки с разбрызгивателями и стальными дисками на концах.
При 600° С и остаточном давлении около 6,66 Н/м 2 включают насос. Свинец из котла подается в боковые трубки и разбрызгивается в вакуумном пространстве, а падающие капли его дополнительно разбиваются на стальных дисках. Большая суммарная поверхность металла способствует быстрому испарению
Пары конденсируются в виде крупных кристаллов на дне ко локола. После 5-ч работы в свинце остается 0,1% цинка, Aппа рат снимают и скалывают конденсат (60% Zn и 40% Pb).
Статья на тему Извлечение благородных металлов из свинца
Похожие страницы:
ЧТО ТАКОЕ КИСЛОТНЫЙ АФФИНАЖ БЛАГОРОДНЫХ МЕТАЛЛОВ Эти методы заключаются в обработке сплавов благородных металлов различными кислотами, причем примеси и один.
Химические свойства металлов Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно.
Возгонка свинца из шлаков и цинка Свинец и цинк, растворенные в шлаке в виде окислов и силикатов,девлекают в шлаковозгоночных печах.
ОСАЖДЕНИЕ БЛАГОРОДНЫХ МЕТАЛЛОВ ИЗ ЦИАНИСТЫХ РАСТВОРОВ методом цементации Для выделения золота и серебра из цианистых растворов могут быть использованы следующие методы.
Удаление висмута из свинца В системах Bi—Ga и Bi—Mg известны два устойчивых соединения Bi2Ca3 и Bi2Mg3, плавящихся при 928 и.
Вытеснительный ряд металлов Бекетова Рассматривая способы получения водорода, мы уже отмечали, что одни металлы легко вытесняют из воды водород, другие —.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com
Базовые понятия. Запись 7 (физические свойства металлов)

В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа. В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят.
Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.

Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.

По степени пластичности металлы принято подразделять следующим образом:
-высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
-пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
-хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.

Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.

Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.

Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.

Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».

Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами. Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов. В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
Карбид вольфрама: 8.5-9
Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
-лёгкие (плотность не более 5 г/см 3 ) — магний, алюминий, титан и др.:
-тяжёлые — (плотность от 5 до 10 г/см 3 ) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
-очень тяжёлые (плотность более 10 г/см 3 ) — молибден, вольфрам, золото, свинец и др.
Таблицы с плотностями:
Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
Делят металлы на несколько групп:
-легкоплавкие (температура плавления не превышает 600 o С) — цинк, олово, свинец, висмут и др.;
-среднеплавкие (от 600 o С до 1600 o С) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
-тугоплавкие ( более 1600 o С) — вольфрам, молибден, титан, хром и др.
Больше про плавление написано здесь:

Дополнительная общая ссылка:
Большое спасибо за внимание!
Источник: arhimpeless.wordpress.com