
Золото и серебро, растворенные в свинце, при добавлении цинка образуют твердые интерметаллические соединения, всплывающие на поверхность ванны в виде твердой рыхлой корки — серебристой цинковой пены.
Из диаграммы состояния Au—Zn известны соединения AuZn,
Au 3Zn5, AuZn3 с температурами плавления соответственно 725, 644 и 475° С, а из системы Ag—Zn—Ag2Zn3 и Ag2Zn5, плавящиеся при 665 и 636° С. Медь также реагирует с цинком, а мышьяк затрудняет отделение пены, эти примеси должны быть предварительно удалены.
Цинк растворим в свинце ограниченно, избыток его всплывает в виде раствора, насыщенного свинцом. Пена — сложный продукт, содержащий серебро, золото, свинец и цинк. Для обогащения благородными металлами и экономии цинка ее пускают в оборот. Первой добавкой при 500° С служат бедные съемы с предыдущего котла. После полного их расплавления свинец перемешивают 20—30 мин, охлаждают до 450—480° С и снимают пену.
Свинец / Металлы и технологии
Вторую и последующие присадки цинка дают в соответствии с анализами металла на серебро и золото. Перед каждым очередным вмешиванием котел разогревают до 450—480, а перед съемом охлаждают до 340—350° С. Для удаления серебра до содержания 3 г/т достаточно трех добавок цинка, общий расход которого около 1% от массы свинца.
В богатую пену переходит до 70% благородных металлов и ее направляют на переработку для их извлечения. Пена содержит 5—10% (в сумме золота и серебра), 25% цинка, остальное свинец. Еще не застывшие мягкие съемы рыхлят вручную и направляют на дистилляцию для отгонки цинка и получения серебристого свинца.
Дистилляцию проводят в круглых трехэлектродных печах мощностью 0,5 МВт (рис.). Графитовые электроды погружают в шлак, покрывающий ванну сплава, его искусственно наводят, сплавляя соду, песок и известь, чтобы получить силикаты натрия и кальция. Пену загружают механическим питателем, добавляя в нее 2—3% мелкого кокса.
При температуре около 1250° С отгоняется до 90% цинка, более половины его собирают в конденсаторе с разбрызгивающей вертушкой в виде жидкого металла, а остальной улавливают с пылью. Остаток от дистилляции— серебристый свинец выпускают через сифон, в нем не более 2% цинка. Жидкий цинк из конденсатора отливают в чушки и возвращают на рафинирование.
При температуре плавки цинк и свинец смешиваются во всех соотношениях. Давление пара над их раствором равно сумме давлений паров компонентов
Проверь хорошо ли Вы знаете науки
Ты получил <> снаружи >
По закону Рауля, для идеальных жидкостей это справедливо, а для реальных в зависимости от знака теплоты растворения наблюдаются положительные либо отрицательные отклонения, превращающие линию суммарного давления
Рис. Схема печи для дистилляции цинковой пены:
1 — электроды; 2 — загрузочный бункер; 3— печь; 4 —роторы, разбрызгивающие жидкий цинк; 5 —газоход; 6 — конденсатор
в выпуклую или вогнутую кривую (рис. 2). На диаграмме системы Pb — Zn показана зависимость температуры кипения от состава сплава; с уменьшением концентрации цинка она повышается. Практически при температуре 1250° С удается понизить концентрацию цинка в серебристом свинце только до 2%, а в конденсате получить не менее 10% свинца; однако это не существенно: цинк возвращают на рафинирование свинца.
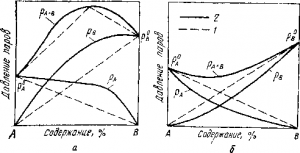
Рис. 2 . Зависимость давления паров от состава раствора:
а — с максимумом: б — с минимумом; 1 — по закону Рауля для идеальных растворов: 2 — варианты отклонений в реальных растворах
Серебристый свинец купелируют — окисляют его до глета, а серебро и золото остаются в ванне печи в сплаве, называемом металлом доре, от французского d’ore — золото.
Ванну купеляционной печи — купель — выкладывают из магнезитового кирпича в железном кожухе и устанавливают на тележке, стенки защищают кессонами (рис. 3 ). Жидкий глет, всплывающий на поверхность сплава, постепенно выпускают, а в ванну загружают новые порции серебристого свинца, накапливая в ней золото и серебро.
Когда ванна наполнится сплавом, окончательно окисляют остаток свинца. Образуемые при этом небольшие количества глета впитываются в купель. Металл до ре разливают в изложницы и отправляют на аффинажные заводы для разделения на золото и серебро. Избыток цинка из рафинированного свинца необходимо удалить использовать. Концентрация его достигает 0,7%; а мас са в суточном количестве металла при средней современной мощ ности предприятий измеряется десятками тонн.
На многих заводах от цинка избавляются щелочным способом, подобно олову, мышьяку и сурьме, селитры не требуется он хорошо окисляется щелочью по реакции:
протекающей энергично с выделением тепла, для отвода избытка которого реактор иногда приходится снабжать водяной ру башкой.
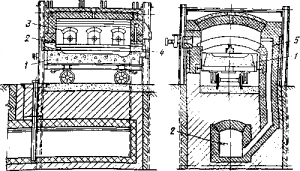
Рис. 3 . Купеляционная печь:
1 — ванна (купель) на тележке; 2 — подача воздуха; 3 — форсуночные окна; 4 — выпуск жидкого глета; 5 — дымоход
Рафинирование длится 7—10 ч, на 1т цинка расходуют 1 т NaOH и 0,75 т NaCl. Отработанный плав гранулируют, гидроокись цинка образует суспензию, которую после отделения металлических корольков фильтруют. Раствор выпаривают до суха, щелочь возвращают в голову процесса, а гидроокись цинка прокаливают и продают для изготовления красок. Затраченный цинк при этом возвращается на 95%, но в виде окиси.
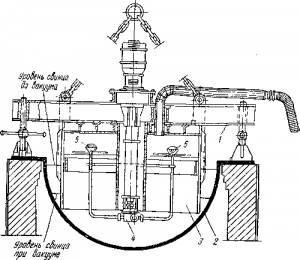
Рис. 4 . Аппарат для вакуумного обесцинкования свинца:
1 — опорная рама; 2 — котел; 3 —стальной стакан; 4 — насос для свинца; 6 — разбрызгиватели свинца с отбойными дисками
Дистилляция в вакууме перед щелочным рафинированием позволяет возвратить только 80% цинка, но в виде сплава, который снова пригоден для рафинирования свинца. Предназначенный для этого аппарат (рис. 4) переносят краном и устанавливают на обычном котле. На раме его укреплен стальной колокол с охлаждаемым водой днищем, соединенный с вакуум-насосом. По оси аппарата проходит стальная труба, в ней — вал свинцового насоса, от которого вверх направлены трубки с разбрызгивателями и стальными дисками на концах.
При 600° С и остаточном давлении около 6,66 Н/м 2 включают насос. Свинец из котла подается в боковые трубки и разбрызгивается в вакуумном пространстве, а падающие капли его дополнительно разбиваются на стальных дисках. Большая суммарная поверхность металла способствует быстрому испарению
Пары конденсируются в виде крупных кристаллов на дне ко локола. После 5-ч работы в свинце остается 0,1% цинка, Aппа рат снимают и скалывают конденсат (60% Zn и 40% Pb).
Статья на тему Извлечение благородных металлов из свинца
Похожие страницы:
ЧТО ТАКОЕ КИСЛОТНЫЙ АФФИНАЖ БЛАГОРОДНЫХ МЕТАЛЛОВ Эти методы заключаются в обработке сплавов благородных металлов различными кислотами, причем примеси и один.
Химические свойства металлов Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно.
Возгонка свинца из шлаков и цинка Свинец и цинк, растворенные в шлаке в виде окислов и силикатов,девлекают в шлаковозгоночных печах.
ОСАЖДЕНИЕ БЛАГОРОДНЫХ МЕТАЛЛОВ ИЗ ЦИАНИСТЫХ РАСТВОРОВ методом цементации Для выделения золота и серебра из цианистых растворов могут быть использованы следующие методы.
Удаление висмута из свинца В системах Bi—Ga и Bi—Mg известны два устойчивых соединения Bi2Ca3 и Bi2Mg3, плавящихся при 928 и.
Вытеснительный ряд металлов Бекетова Рассматривая способы получения водорода, мы уже отмечали, что одни металлы легко вытесняют из воды водород, другие —.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com
Можно ли получить из свинца золото?
Выдающийся физик Исаак Ньютон, помимо своих работ в области теоретической физики, несколько десятков лет занимался алхимией. Более того, он был полностью уверен в ее возможностях и поэтому с другим физиком Робертом Бойлем внес на рассмотрение британского парламента интересный законопроект. В нем говорилось о запрете разглашения превращения металлов, например, того, как сделать золото из свинца, потому что это могло привести к падению цен на золото.
Философский камень и другие опыты алхимиков
В начале прошлого века в гробнице города Фив был найден папирус. В нем содержалось 111 рецептов, среди которых были и методы получения золота и серебра. Однако большинство из этих рецептов все же относились к методам создания подделок или покрытию ими другого металла. Тем не менее такой документ показывает, насколько уже тогда алхимия была распространена и захватывала умы жаждущих легкой наживы.

Произойдя от греков и египтян, она постепенно захватывала всю Европу. В Средневековье занимались алхимией не только некоторые ученые, но и особы наивысших государственных и церковных чинов. Практически при каждом императорском дворе трудились свои алхимики, намереваясь получить золото, чем улучшить состояние казны. Получить золото, по их мнению, возможно, нужно лишь каким-то образом найти или создать философский камень.
Записи алхимиков того времени были туманны и трудно понимаемы. Вот, например, рецепт Луллия по получению такого камня.
Предлагалось взять меркурий философов и обжигать его до получения зеленого льва, а потом и красного. Его уже нужно было нагреть на песчаной бане вместе с кислым спиртом винограда. Полученную от выпаривания камедь необходимо было перегнать с помощью перегонного снаряда. В самом перегонном снаряде после этого останется истинный дракон, который растереть на камне и прикоснуться раскаленным углем. После чего опять перегнать, вследствие получается жгучая вода и кровь — это и есть эликсир.
Позже такой рецепт был расшифрован. Оказалось, что меркурий, — это свинец, зеленый лев — его окись, красный — сурик, а черный дракон — порошок свинца с углем. Получилась обычная химическая реакция — перегонка уксусно-свинцовой соли. Таким образом, получились продукты, способные восстанавливать золото из растворов его солей.
Алхимия процветала и в середине XVII века. Тогда было сложно сказать, с каким веществом алхимики имели дело, а высокопоставленными лицами такие увлечения поддерживались, что и стимулировало развитие. Многие короли и императоры и сами были алхимиками и, кстати сказать, многие проведенные ими превращения — не совсем обман. Просто, скорее всего, в исходном веществе уже содержалось золото в том или ином виде.
Со временем число людей, веривших в алхимию, становилось все меньше. Это было вызвано тем, что алхимики объявили философский камень средством от всех болезней. И когда это не оправдывалось на практике, люди начинали сомневаться в алхимии.
Однако некоторые превращения металлов тогда еще объяснить не могли. Опыты многих в итоге давали золото. Это было связано с тем, что некоторые из природных руд содержат в себе какое-то количество золота изначально. И путем разных химических реакций его удавалось очистить.
В 1709 году известный алхимик Гобмерг получил золото, расплавляя серебро с сурьмяной рудой. Золота на выходе оказалось совсем немного, но он был уверен, что нашел секрет превращения металлов. По прошествии времени, когда смогли провести точный анализ руды, оказалось, что определенный процент золота там содержался с самого начала.

В 1783 аптекарь Каппель смог превратить в золото серебро при помощи мышьяка. Секрет его опыта оказался подобным: золото содержалось в мышьяковистой руде.
После открытия атома и реакций по его превращению получением золота занялись физики-ядерщики. И в 1935 году физик Демпстеру изучал масс-спектографические данные золота и пришел к выводу, что существует только один стабильный изотоп этого металла, с массовым числом 197. Это означало, что нужно искать такую ядерную реакцию, которая даст на выходе именно этот изотоп.
В 1940 году многие лаборатории начали изучать этот вопрос более подробно. Они проводили опыты по бомбардировке быстрыми нейтронами соседних с золотом элементов в таблице Менделеева, платины и ртути. Через год американские физики Шерр и Бэйнбридж доложили об успешных результатах: бомбардируя атомы ртути быстрыми нейтронами, они получили золото.
Но изотопы имели массовые числа 198, 199 и 200. Таким образом, они не совсем добились результата, золото получили, но оно существовало короткий промежуток времени. Следовательно, современные приверженцы алхимии не имели повода ликовать, а эксперименты необходимо было продолжать.
Из опытов Шерра и Бейнбриджа сделали вывод, что изотопы золота были получены из атомов ртути с соответствующими атомными числами. И такое предположение казалось оправданным. Вероятность осуществления ядерной реакции определяется эффективным сечением захвата ядра по отношению к частице, которая его бомбардирует.
Таким образом, было показано, что атомы ртути с массовыми числами 196 и 199 имеют больше всего шансов превратиться в золото. И после проведения реакции они действительно его получили. 100 грамм ртути превратили в 35 мкг золота. В 1950 году французский журнал «Атомы» написал, что цена такого золота получилась намного выше рыночной из-за дороговизны ядерных превращений. Поэтому популярности оно не обрело.
Получение золота-197 (его стабильного изотопа) можно было бы теоретически осуществить путем превращений определенных изотопов соседних элементов. Согласно карте нуклидов, золото-197 можно получить из ртути с таким же массовым числом. А также можно было бы получить из таллия-201, если бы этот элемент имел альфа-распад, чего нет.
Остается изотоп ртути-197, которого в природе не существует. Его бы можно было получить из таллия-197 или свинца-197. Это была бы единственная возможная реакция превращения в свинец. Но тут возникает новая загвоздка. Дело в том, что такого изотопа нет, его нужно сначала также создать путем ядерных превращений.
Таким образом, чисто теоретически получить из свинца золото возможно. А на практике его можно получить превращениями ртути. Но такой процесс имеет слишком высокую стоимость, что делает полученный металл «бесценным».
Источник: hochuzoloto.com
Физические свойства металлов: твердость, плотность и др.

Металлы имею такие физические свойства, как твердость, температуру плавления, плотность, пластичность, электропроводность, теплопроводность и цвет.
Твёрдость:
Все металлы, кроме ртути и, условно, франция, при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Таблица твёрдости металлов по шкале Мооса:
| Твёрдость | Металл |
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температура плавления:
Температуры плавления чистых металлов лежат в диапазоне от −38,83 °C (ртуть) до 3422 °C (вольфрам).
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
В зависимости от температуры плавления металлы делятся на: легкоплавкие (до 600 °C); среднеплавкие (от 600 до 1600 °C); тугоплавкие (выше 1600 °C).
Таблица температуры плавления легкоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Ртуть | -38,83 |
| Франций | 25 |
| Цезий | 28,44 |
| Галлий | 29,7646 |
| Рубидий | 39,3 |
| Калий | 63,5 |
| Натрий | 97,81 |
| Индий | 156,5985 |
| Литий | 180,54 |
| Олово | 231,93 |
| Полоний | 254 |
| Висмут | 271,3 |
| Таллий | 304 |
| Кадмий | 321,07 |
| Свинец | 327,46 |
| Цинк | 419,53 |
Таблица температуры плавления среднеплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Сурьма | 630,63 |
| Нептуний | 639 |
| Плутоний | 639,4 |
| Магний | 650 |
| Алюминий | 660,32 |
| Радий | 700 |
| Барий | 727 |
| Стронций | 777 |
| Церий | 795 |
| Иттербий | 824 |
| Европий | 826 |
| Кальций | 841,85 |
| Лантан | 920 |
| Празеодим | 935 |
| Германий | 938,25 |
| Серебро | 961,78 |
| Неодим | 1024 |
| Прометий | 1042 |
| Актиний | 1050 |
| Золото | 1064,18 |
| Самарий | 1072 |
| Медь | 1084,62 |
| Уран | 1132,2 |
| Марганец | 1246 |
| Бериллий | 1287 |
| Гадолиний | 1312 |
| Тербий | 1356 |
| Диспрозий | 1407 |
| Никель | 1455 |
| Гольмий | 1461 |
| Кобальт | 1495 |
| Иттрий | 1526 |
| Эрбий | 1529 |
| Железо | 1538 |
| Скандий | 1541 |
| Тулий | 1545 |
| Палладий | 1554,9 |
| Протактиний | 1568 |
Таблица температуры плавления тугоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Лютеций | 1652 |
| Титан | 1668 |
| Торий | 1750 |
| Платина | 1768,3 |
| Цирконий | 1855 |
| Хром | 1907 |
| Ванадий | 1910 |
| Родий | 1964 |
| Технеций | 2157 |
| Гафний | 2233 |
| Рутений | 2334 |
| Иридий | 2466 |
| Ниобий | 2477 |
| Молибден | 2623 |
| Тантал | 3017 |
| Осмий | 3033 |
| Рений | 3186 |
| Вольфрам | 3422 |
Плотность:
В зависимости от плотности металлы делят на лёгкие (плотность от 0,53 до 5 г/см³) и тяжёлые (от 5 до 22,6 г/см³).
Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца ), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность:
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними.
Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла . Так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность:
Все металлы хорошо проводят электрический ток, обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля.
Серебро, медь и алюминий имеют наибольшую электропроводность. По этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также и натрий. В экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность:
Теплопроводность металлов зависит от подвижности свободных электронов.
Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет:
Цвет у большинства металлов примерно одинаковый — светло-серый, иногда с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Металлы подразделяются на цветные и черные.
Чёрные металлы – железо и сплавы на его основе (стали, ферросплавы, чугуны). К чёрным металлам также зачастую относят марганец и, иногда, – хром и ванадий.
Цветные металлы — это особый класс нержавеющих металлов и сплавов, в составе которых нет железа. Металлы называются цветными, потому что каждый из них имеет определенный окрас. К цветным металлам относятся медь, молибден, свинец, цинк, олово, никель, кадмий, кобальт, алюминий, титан, магний, висмут, вольфрам, ртуть, золото, платину, серебро, палладий, родий, рутений, осмий, иридий.
Источник: xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai