Найди верный ответ на вопрос ✅ «Определить электрохимический эквивалент золота, если за время прохождения через электролитическую ванну заряда 700 Кл на катоде выделяется . » по предмету Физика, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Новые вопросы по физике
Железнобитонная плита размером 4 м * 0,5 м * 0,25 м погружена в воду наполовину. какова архимедова сила, действующая сила на нее? плотность воды 1000 кг/м3
Велосипед движется равномерно по окружности радиусом 100 м и делает 1 оборот за 2 мин. Путь и перемещение велосипедиста за 1 мин соответственно равны
1. Классификацию галактик Хаббла часто называют камертонной. Поясните причину такого названия. 2. Определите, какой промежуток времени требуется свету, чтобы пересечь Большое и Малое Магеллановы Облака в поперечнике
Мяч бросают вверх с высоты 20 м со скоростью 5 м. с. Определить, на какой высоте, его кинетическая энергия будет равна потенциальной.
Из какого числа слоев состоит тело аскариды 1234
Главная » Физика » Определить электрохимический эквивалент золота, если за время прохождения через электролитическую ванну заряда 700 Кл на катоде выделяется 1,43 г золота
Источник: urokam.net
№893 ГДЗ Рымкевич 10-11 класс (Физика)

Рассмотрим вариант решения задания из учебника Рымкевич 10-11 класс, Дрофа:
Зная электрохимический эквивалент серебра, вычислить электрохимический эквивалент золота.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Популярные решебники 10-11 класс Все решебники
Михеева, Афанасьева
Мордкович, Семенов
Enjoy English
Биболетова, Бабушис
Пасечник, Каменский, Рубцов
Источник: reshak.ru
Задачи на электрический ток в электролитах с решением

Самостоятельное решение задач – боль многих студентов и школьников. Чтобы уменьшить ее, разберем несколько примеров решений задач на электрический ток в электролитах.
Наш телеграм – это полезная информация для всех учащихся, присоединяйтесь! Кстати, у нас есть и второй канал, где публикуется информация об акциях и приятных скидках, не упустите шанс воспользоваться ими.
Электрический ток в электролитах: задачи
Как решать задачи? Прочтите теорию (лучше несколько раз), вспомните памятку по решению физических задач, и вперед!
Аффинаж советского наследия. Будет ли 100 грамм
Задача на ток в электролитах №1
Условие
Проводящая сфера радиусом R = 5 см помещена в электролитическую ванну, наполненную раствором медного купороса. Насколько увеличится масса сферы, если отложение меди длится 30 минут, а электрический заряд, поступающий на каждый квадратный сантиметр поверхности сферы за 1 секунду, равен 0,01 Кл? Молярная масса меди М = 0,0635 кг/моль.
Решение
Площадь поверхности сферы вычислим по формуле:
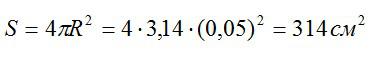
Теперь можем вычислить общий заряд, перенесенный ионами за 30 минут:
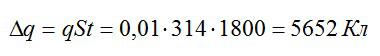
Рассчитаем массу выделившейся меди:
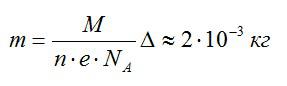
Ответ: 2 грамма.
Задача на ток в электролитах №2
Условие
Электролиз длился один час при силе тока, равной 5 А. Чему равна температура выделившегося атомарного водорода, если при давлении, равном 10^5 Па, его объём равен 1,5 л? Электрохимическии эквивалент водорода принять равным k=1*10^-8 кг/Кл.
Решение
Согласно первому закону Фарадея, масса выделившегося водорода определяется по формуле:
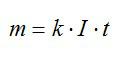
Также эту массу можно выразить из уравнения Клапейрона-Менделеева:
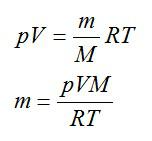
Приравняем два выражения для массы и найдем температуру:
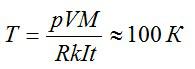
Ответ: 100 К.
Задача на ток в электролитах №3
Условие
В процессе электролиза под действием тока плотностью 300 А/м^2 на электроде выделился слой меди толщиной 0,03 мм. В течении какого времени протекал электролиз?
Решение
Время электролиза определим из закона Фарадея:
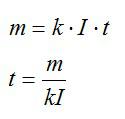
Масса равна плотности, умноженной на объем. Объем меди можно вычислить, зная толщину слоя и плотность. Запишем:
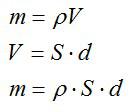
Силу тока выразим через плотность тока и площадь:
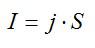
Подставим выражения для массы и силы тока в выражение для времени, упростим его и вычислим:
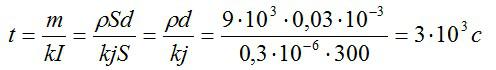
Ответ: 3000 секунд.
Плотность, как и значение электрохимического эквивалента, берутся из таблиц.
Задача на ток в электролитах №4
Условие
Зная электрохимический эквивалент серебра, определите электрохимический эквивалент золота.
Решение
Для решения данной задачи будем применять второй закон Фарадея. Валентость золота и серебра, а также молярные массы этих элементов возьмем из таблицы Менделеева. Запишем известные величины:
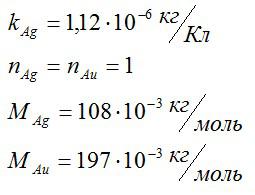
Теперь запишем второй закон Фарадея для золота и серебра:
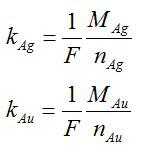
Разделим одно уравнение на другое и выразим искомую величину:
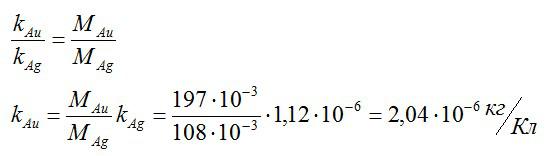
Ответ: 2,04*10^-6 кг/Кл.
Задача на ток в электролитах №5
Условие
Сколько электрической энергии понадобилось для получения серебра массой 0,2 кг, если КПД установки равен 0,8? Электролиз проводят при напряжении 20 В. Электрохимический эквивалент серебра возьмите из предыдущей задачи.
Решение
Энергия, которая идет только на электролиз, равна:
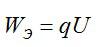
По закону Фарадея:
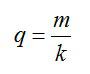
Полная затраченная энергия и энергия, затраченная только на электролиз, связаны выражением:
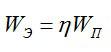
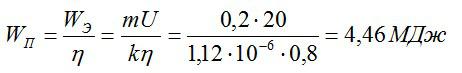
Ответ: 4,46 МДж.
Вопросы на тему «Электрический ток в электролитах»
Вопрос 1. Что такое электролиты?
Ответ. Дадим определение и некоторые сведения об электролитах:
- Электролиты – вещества, проводящие электрический ток вследствие электролитической диссоциации.
- Электролитическая диссоциация – процесс распада молекул на ионы. Диссоциация на ионы происходит в растворах и некоторых твердых кристаллах.
- К электролитам относятся кислоты, соли и некоторые кристаллы.
- Носителями заряда в электролитах являются ионы.
Вопрос 2. В чем состоит суть электролиза?
Ответ. Электролиз – окислительно-восстановительный процесс, происходящий на электродах, когда ток проходит через раствор электролита. На электродах выделяются части растворенных веществ и продукты вторичных реакций.
Вопрос 3. Сформулируйте первый закон Фарадея.
Ответ. Помимо прочего, Майкл Фарадей занимался задачей исследования проводимости электрического тока в электролитах. Первый закон Фарадея гласит:
Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, переданному на электрод.
Вопрос 4. Как звучит второй закон Фарадея?
Ответ. Второй закон Фарадея гласит:
Масса вещества, осевшего на электроде, прямо пропорциональна молярной массе элемента, деленной на электрохимический эквивалент вещества.
Вопрос 5. Что такое электрохимический эквивалент вещества?
Ответ. Электрохимический эквивалент вещества – количество вещества, которое должно выделиться во время электролиза на электроде, при прохождении через электролит заряда в 1 Кулон.
Нужна скорая помощь в решении задач и других заданий? Обращайтесь за ней в профессиональный сервис для учащихся.
Источник: zaochnik.ru