K [Ar] 4s 1
Ca [Ar] 4s 2 Sc [Ar] 4s 2 3d 1
Ti [Ar] 4s 2 3d 2
V [Ar] 4s 2 3d 3
Cr [Ar] 4s 1 3d 5
Mn [Ar] 4s 2 3d 5
Fe [Ar] 4s 2 3d 6
Co [Ar] 4s 2 3d 7
Ni [Ar] 4s 2 3d 8
Cu [Ar] 4s 1 3d 10
Zn [Ar] 4s 2 3d 10
Ga [Ar] 4s 2 3d 10 4p 1
Ge [Ar] 4s 2 3d 10 4p 2
As [Ar] 4s 2 3d 10 4p 3
Se [Ar] 4s 2 3d 10 4p 4
Br [Ar] 4s 2 3d 10 4p 5
Kr [Ar] 4s 2 3d 10 4p 6
5 период
Rb [Kr] 5s 1
Sr [Kr] 5s 2
Y [Kr] 4d 1 5s 2
Zr [Kr] 4d 2 5s 2
Nb [Kr] 4d 4 5s 1
Mo [Kr] 4d 5 5s 1
Tc [Kr] 4d 5 5s 2
Ru [Kr] 4d 7 5s 1
Rh [Kr] 4d 8 5s 1
Pd [Kr] 4d 10 5s 0
Ag [Kr] 4d 10 5s 1
Cd [Kr] 4d 10 5s 2
In [Kr] 5s 2 4d 10 5p 1
Sn [Kr] 5s 2 4d 10 5p 2
Sb [Kr] 5s 2 4d 10 5p 3
Te [Kr] 5s 2 4d 10 5p 4
I [Kr] 5s 2 4d 10 5p 5
Xe [Kr] 5s 2 4d 10 5p 6
6 период
[Xe] 6s 1
Ba [Xe] 6s 2
La [Xe] 5d 1 6s 2
Электронные конфигурации атомов. Химия – просто
Ce [Xe] 5d 1 6s 2
Pr [Xe] 4f 3 6s 2
Nd [Xe] 4f 4 6s 2
Pm [Xe] 4f 5 6s 2
Sm [Xe] 4f 6 6s 2
Eu [Xe] 4f 7 6s 2
Gd [Xe] 4f 7 5d 1 6s 2
Tb [Xe]4f 9 6s 2
Dy [Xe] 4f 10 6s 2
Ho [Xe] 4f 11 6s 2
Er [Xe] 4f 12 6s 2
Tm [Xe] 4f 13 6s 2
Yb [Xe] 4f 14 6s 2
Lu [Xe] 4f 14 5d 1 6s 2
Hf [Xe] 4f 14 5d 2 6s 2
Ta [Xe] 4f 14 5d 3 6s 2
W [Xe] 4f 14 5d 4 6s 2
Re [Xe] 4f 14 5d 5 6s 2
Os [Xe] 4f 14 5d 6 6s 2
Ir [Xe] 4f 14 5d 7 6s 2
Pt [Xe] 4f 14 5d 9 6s 1
Au [Xe] 4f 14 5d 10 6s 1
Hg [Xe] 4f 14 5d 10 6s 2
Tl [Xe] 4f 14 5d 10 6s 2 6p 1
Pb [Xe] 4f 14 5d 10 6s 2 6p 2
Bi [Xe] 4f 14 5d 10 6s 2 6p 3
Po [Xe] 4f 14 5d 10 6s 2 6p 4
At [Xe] 4f 14 5d 10 6s 2 6p 5
Rn [Xe] s 2 3d 10 4p 6
7 период
Fr [Rn] 7s 1
Ra [Rn] 7s 2
Ac [Rn] 6d 1 7s 2
Th [Rn] 6d 2 7s 2
Pa [Rn] 5f 2 6d 1 7s 2
U [Rn] 5f 3 6d 1 7s 2
Np [Rn] 5f 5 7s 2
Pu [Rn] 5f 6 7s 2
Am [Rn] 5f 7 7s 2
Cm [Rn] 5f 7 6d 1 7s 2
Bk [Rn] 5f 9 7s 2
Cf [Rn] 5f 10 7s 2
Es [Rn] 5f 11 7s 2
Fm [Rn] 5f 12 7s 2
Md [Rn] 5f 13 7s 2
No [Rn] 5f 14 7s 2
Lr [Rn] 5f 14 6d 1 7s 2
Rf [Rn] 5f 14 6d 2 7s 2
Db [Rn] 5f 14 6d 3 7s 2
Sg [Rn] 5f 14 6d 4 7s 2
Bh [Rn] 5f 14 6d 5 7s 2
Hs [Rn] 5f 14 6d 6 7s 2
Mt [Rn] 5f 14 6d 7 7s 2
Источник: tdsm.ru
Электронная конфигурация золота


Электронная конфигурация золота: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d9. Золото – один из самых распространенных химических элементов в земной коре. Он находится в периоде 6 и в группе 11 периодической таблицы. Он имеет атомную массу 196.966569 а.е.м.
БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атома
Он выглядит как мягкий переходный металл ярко-желтого цвета, ковкий, тяжелый и в то же время пластичный.
Его атомный номер 79, и он обычно находится в чистом виде в земной коре, в виде аллювия и в виде самородков. Он был обнаружен Джеймсом У. Маршаллом на Ближнем Востоке.
Упрощенная конфигурация электрона

Электронная конфигурация золота: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d9
Сумма этих индексов дает в общей сложности 79, что является общим числом электронов, которое имеет золото, что совпадает с его атомным номером.
- 2 электрона на 1s орбите.
- 2 на 2-секундной орбите.
- 6 электронов на 2р-орбите.
- 2 в течение 3 с.
- 6 на орбите 3p.
- 2 электрона на 4s орбите.
- 10 в 3д.
- 6 электронов в 4р.
- 2 электрона в течение 5 с.
- 10 электронов в 4d.
- 6 a.m. до 5 p.m.
- 2 из 6s.
- 17 электронов на 4f-орбите.
- 9 электронов на 5d-орбите.
Один из способов сделать эту электронную конфигурацию золота намного более простой — взять вместе с ней благородный газ, в данном случае ксенон, который обозначается буквами Xe.
Поскольку этот благородный газ имеет те же орбиты, что и исходные орбиты элемента золота, указанный символ атома помещен в квадратные скобки: [Xe]это указывает на то, что золото имеет ту же конфигурацию, что и ксенон, с другими орбитами, где заканчивается распределение 79 электронов золота, а ксенона нет, поэтому это будет записано следующим образом:
[Xe] 4f14 5d10 6s1
изотопы золота
Золото имеет только один встречающийся в природе изотоп: 197 Au, оба из которых стабильны. Самым стабильным из всех изотопов является 195 Au с периодом полураспада 186.1 дня. У него также есть изотоп, который распадается при электронном захвате: 195Au.
Другие учебные темы
APA MLA Гарвардский Ванкувер Чикаго IEEE
Электронная конфигурация (29 апреля 2022 г.) Электронная конфигурация золота, Извлекаются из https://electronconfiguration.net/elements/electron-configuration-of-gold/.
Электронная конфигурация 21 апреля 2022 г. Электронная конфигурация золота., просмотрено 29 апреля 2022 г.,https://electronconfiguration.net/elements/electron-configuration-of-gold/>
Электронная конфигурация — Электронная конфигурация золота. [Интернет]. [По состоянию на 29 апреля 2022 г.]. Доступна с: https://electronconfiguration.net/elements/electron-configuration-of-gold/
«Электронная конфигурация золота.«Электронная конфигурация» — по состоянию на 29 апреля 2022 г. https://electronconfiguration.net/elements/electron-configuration-of-gold/
«Электронная конфигурация золота.» Электронная конфигурация [Онлайн]. Доступно: https://electronconfiguration.net/elements/electron-configuration-of-gold/. [Доступ: 29 апреля 2022 г.]
- Политика конфиденциальности
- СВЯЖИТЕСЬ С НАМИ
- Карта сайта

Химия✓ Плотность✓ Элементы✓ Информация✓ Применение✓
Источник: electronconfiguration.net
Конфигурация благородного газа. Образование ионной связи.

Есть в таблице Д. И. Менделеева группа элементов, именуемая благородным или инертными газами. Названы они так не спроста, хоть они и проявляют окислительно-восстановительные свойства и вступают в химическую связь, их соединений мы знаем не так много, как соединений многих других элементов. Их низкую химическую активность объясняет то, что у этих элементов «идеальное» количество электронов – восемь (исключение – гелий, однако у него внешний энергетический уровень так же является завершенным, так как на первом уровне может разместиться только два электрона, а не восемь). Атомы с таким количеством электронов на внешнем энергетическом уровне устойчивы и не стремятся к химическому взаимодействию. Максимальное количество электронов на внешнем уровне равно восьми, легко запомнить, так как групп в классической периодической системе восемь, а именно группа определяет количество электронов на внешнем энергетическом уровне.
Остальные элементы стремятся принять конфигурацию благородного газа, превращаясь при этом в ионы.
Рассмотрим данный процесс на примере некоторых элементов.
Конфигурация благородного газа. Образование ионной связи.

Строение атома натрия
Атому натрия, для завершения внешнего энергетического уровня не хватает семь электронов, притянуть такое количество, имея большой радиус и небольшое количество протонов оказывается невозможным. Поэтому натрию легче отдать электрон внешнего уровня, тогда второй уровень станет внешним, на нём как раз расположено восемь электронов.
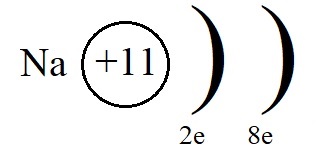
Однако, при этом количество протонов в ядре остаётся равным одиннадцати, а электронов теперь всего десять. Элементарные вычисления (+11-10 = +1) дают нам понять, что теперь это не атом, а положительно заряженная частица – ион:
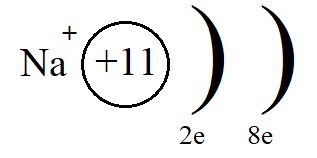
Ионы, несущие положительный заряд, называются катионами.
Если же мы рассмотрим строение внешнего энергетического уровня фтора, то обнаружим, что этому элементу до завершенного внешнего уровня не хватает всего одного электрона:
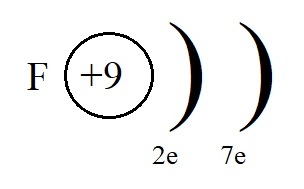
Этот электрон фтор может получить от натрия, превратившись при этом в отрицательно заряженную частицу – анион:
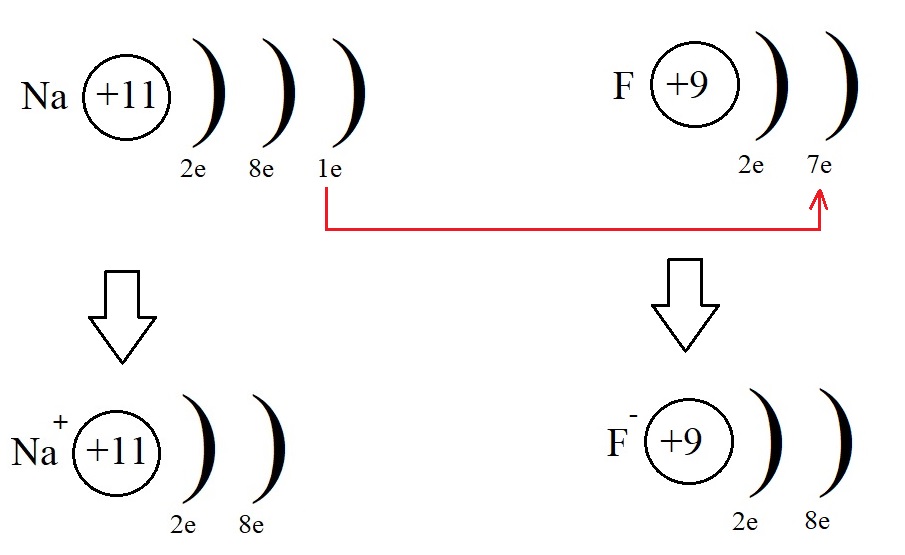
Оба атома при таком взаимодействии приняли конфигурацию благородного газа (8 электронов на внешнем уровне), превратились в ионы, после чего притянулись друг к другу из-за противоположных знаков и образовали фторид натрия NaF. Так образуется ионная связь.
Элементы, которые с наибольшей вероятностью отдают электроны, называют металлами, у них хорошо выражены восстановительные свойства (способность отдавать свои электроны, восстанавливая электронную оболочку другого атома до восьмиэлектронной).
Элементы, с наибольшей вероятностью «отнимающие» чужие электроны, называют неметаллами, они проявляют окислительные свойства.
Элементы, отдающие электроны (восстановители) повышают свою степень окисления, тогда как элементы, принимающие электроны (окислители) – понижают степень окисления за счет того, что принятые электроны несут отрицательный заряд.
Структура внешнего энергетического уровня
Структура внешнего энергетического уровня
Источник: onlineclass.space