Наименьшая частица вещества, сохраняющая химические свойства определенного элемента, называется атомом. Атом состоит из ядра и окружающих его электронов. В свою очередь ядро состоит из элементарных частиц — протонов и нейтронов. Если нейтрон электрически нейтрален, то протон имеет положительный заряд, равный по абсолютной величине заряду атомного электрона. Атом вещества электрически нейтрален, так как количество протонов в ядре равно числу электронов на орбитах.
Химическая индивидуальность элемента определяется его номером в периодической системе химических элементов Д.И. Менделеева, который равен заряду ядра (Z), т.е. числу содержащихся в этом ядре протонов.
Следовательно, если радиоактивный распад сопровождается испусканием заряженных частиц, то это приводит к изменению заряда ядра и к образованию новых элементов.
Второй характеристикой ядра является его атомная масса, определяемая числом протонов и нейтронов в нем. Ядра с одинаковым зарядом, принадлежащие атомам одного элемента, могут иметь разные числа нейтронов. Для различения таких атомов вводят понятия атомного номера Z (число протонов в ядре атома) и массового числа (атомной массы) А как суммы числа протонов и нейтронов в атоме.
На какие ресурсы богата Солнечная система?
Атом химического элемента можно в общем виде записать следующим образом: 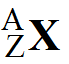 .
.
В качестве примера приведем плутоний-239:
запись .png) означает следующее: ядро атома плутония содержит 94 протона и 145 нейтронов (239–94=145).
означает следующее: ядро атома плутония содержит 94 протона и 145 нейтронов (239–94=145).
У ионизированных атомов количество и знак не скомпенсированных зарядов обычно указывается справа вверху. Например, Na + обозначает ионизированный положительно атом натрия, а Na ++ , или Na 2+ – дважды ионизированный атом.
Изотопы имеют одинаковые химические свойства и занимают одно и то же место в периодической таблице Менделеева. В зависимости от атомной массы М, указываемой слева от символа элемента, изотопы могут быть стабильными или радиоактивными (радиоизотопы).
Изотопы – разновидности атомов химического элемента, которые имеют одинаковый атомный номер, но разные массовые числа.
Например, в случае кобальта (Z = 27) изотоп Co‑59 является стабильным, Co-60 – радиоактивным. В результате радиоактивного распада Co-60 появляется стабильный изотоп Ni-60 (Z = 28).
Известно, что все химические элементы с порядковым номером более 83, как правило, являются радиоактивными. Однако радиоактивные изотопы имеются и у некоторых более легких ядер.
- Радиоактивность. Общие понятия
- Изотопы
- Радиоактивный распад
- Радиоактивные вещества
- Радиоактивные отходы
- Ядерные материалы
- Основные документы
- Дополнительные документы
- Архив
- Разрабатываемое программное обеспечение по приказу 1/13-НПА
- Программное обеспечение по приказу 1/24-НПА
- Архив программного обеспечения
Источник: www.norao.ru
Радиоактивные элементы

Альфа-распад — испускание ядром альфа-частицы (ядра гелия), в результате которого зарядовое число уменьшается на 2, массовое — на 4. Наблюдается у изотопов с большим массовым числом, поскольку они стремятся к стабильному состоянию и стараются сбросить как можно больше лишней «массы». На рисунке обозначены желтым цветом.
Бета-минус-распад — испускание ядром электрона и антинейтрино. Один нейтрон превращается в протон, заряд растет на 1, массовое число не меняется. Этот распад происходит в нестабильных нуклидах, у которых слишком много нейтронов, лежащих выше полосы стабильности. На рисунке обозначены синим.
Бета-плюс-распад — испускание ядром позитрона и нейтрино. Один из протонов превращается в нейтрон, зарядовое число уменьшается на 1, массовое число не меняется. Эмиссия позитронов и захват электронов находятся ниже диапазона стабильности, потому что в изотопе больше протонов, чем нейтронов. На рисунке обозначены розовым цветом.
Спонтанное деление — распад ядер с очень большой атомной массой на два осколка сопоставимой массы. Радиоактивный распад ядра атома сопровождается гамма-излучением, возникающим за счет выброса гамма-кванта во время распада атома вещества.
Источник: postnauka.ru
Изотопы. Общие сведения

Первые экспериментальные данные о существовании изотопов, как разновидностей атомов данного химического элемента, различающихся по массе ядер, были получены в 1906-1910 гг. при изучении свойств радиоактивных элементов. В 1910 г английским ученым Ф.Содди был предложен и сам термин «изотоп». Обладая одинаковым зарядом ядра Z, но различаясь числом нейтронов в нем N, изотопы имеют одинаковое строение электронных оболочек, то есть очень близкие химические свойства, и занимают одно и то же место в периодической системе Менделеева (отсюда и происхождение термина «изотоп» от греческого isos — одинаковый и topos — место). Под термином «изотоп» подразумевают и ядра таких атомов. Только изотопы водорода, в отличие от всех остальных, имеют свои собственные названия.
Изотопы могут быть как стабильные, так и нестабильные — радиоактивные, ядра которых подвержены самопроизвольному (спонтанному) превращению в другие ядра с испусканием различных частиц – так называемым процессам распада. К радиоактивным превращениям относятся альфа-распад с испусканием альфа-частицы, все типы бета-распада, спонтанное деление ядер и ряд других типов распада.
При этом радиоактивный распад часто сопровождается гамма-излучением, испускаемым в результате переходов между различными состояниями одного и того же ядра. Продолжительность жизни радиоактивных изотопов характеризуется периодом полураспада – промежутком времени, в течение которого число радиоактивных ядер уменьшается вдвое.
Величина периода полураспада для разных изотопов может изменяться в очень широких пределах. В соответствии с этим, все радиоактивные изотопы принято делить на две группы – короткоживущие (T ½ < 10 суток) и долгоживущие (T ½ > 10 суток).
Как правило, в естественных условиях встречаются только стабильные изотопы, однако в природе можно обнаружить и некоторые радиоактивные изотопы, в основном те, у которых период полураспада превышает возраст Земли и которые не успели распасться за время ее существования (например, K-40, Th-232 или U-238). Кроме них, ряд радиоактивных изотопов в земных условиях непрерывно образуется в ядерных реакциях под действием космических лучей.
Характерный пример – образование изотопа C-14 (T ½ = 5730 лет) из атмосферного азота. В настоящее время известно около 270 стабильных изотопов и более 2000 радиоактивных изотопов 107 химических элементов. Число радиоактивных изотопов (подавляющее большинство из которых получено искусственным путем) у многих элементов весьма велико и может превышать два десятка. Число же стабильных изотопов существенно меньше, причем наибольшее разнообразие изотопов имеют элементы с четным Z. Так, например, олово Sn-50 имеет 10 стабильных изотопов, ксенон Xe-54 – 9 и т.д. Элементы с нечетным Z, как правило, имеют не более двух стабильных изотопов, причем у некоторых их них стабилен только один.
По материалам книги «Изотопы: свойства, получение, применение». Под ред. В.Ю.Баранова. М., ИздАТ, 2000. – 704 с.
Источник: www.isotop.ru