
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания необходимо. запомнить их! Сожалею.
Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот и оснований принадлежала швецкому учёному Аррениусу.
Кислота по Аррениусу — это класс веществ, которые в реакции с водой диссоциируют (распадаются), образовывая катион водорода H + . Основания Аррениуса в водном растворе образуют анионы OH — . Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания, соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса. Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
Как легко отличить оксиды,основания ,кислоты и соли
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад HCl на H + и Cl — .
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион, в водном растворе выделяют анион OH — .
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H2O, H3O + , CH3CO2H, H2SO4, HSO4 − , HCl, CH3OH, NH3
Часто используемые основания:
OH − , H2O, CH3CO2 − , HSO4 − , SO4 2− , Cl −
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H + и анионы. Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O + (р-р) + Cl — (р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Неорганика исключения: как запомнить сильные и слабые кислоты | Химия ЕГЭ | Лия Менделеева УМСКУЛ
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH — :
NH3 (р-р) + H2O ↔ NH + 4 (р-р) + OH — (р-р)
Большинство слабых оснований — это анионы:
F — (р-р) + H2O ↔ HF(р-р) + OH — (р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Пример:
H3O + + OH — ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH — (р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX(р-р) + OH — (р-р) ↔ H2O + X — (р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H + ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O + (р-р) + OH — (р-р)
Kc = [H3O + ][OH — ]/[H2O] 2
Константа равновесия воды при t=25°: Kc = 1.83⋅10 -6 , также имеет место следующее равенство: [H3O + ][OH — ] = 10 -14 , что называется константой диссоциации воды. Для чистой воды [H3O + ] = [OH — ] = 10 -7 , откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH >7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H + и анионом отличным от O 2- . В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H + , ни OH — в воде. Например, Cl — , NO — 3, SO 2- 4, Li + , Na + , K + .
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F — , CH3COO — , CO 2- 3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Источник: k-tree.ru
Классификация гидроксидов и оснований

Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
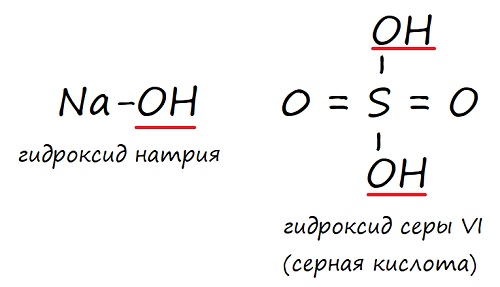
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
Гидроксид
Основный
Амфотерный
Кислотный
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7»
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 8) Ca(OH)2 9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
- Возьмём любой амфотерный гидроксид: Al(OH)3;
- Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
- Расставим степени окисления:
+ +3 ‒2 H Al O - Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
- Zn(OH)2;
- HZnO
-
+ +2 ‒2 H Zn O - Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
H2
Zn
O
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
Основания
Однокислотные
Двукислотные
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na + + OH ‒ + H + + Cl ‒ = Na + + Cl ‒ + H2O
Сокращенное ионное уравнение (СИУ): OH ‒ + H + = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH + + OH ‒ (первая ступень)
FeOH + ↔ Fe 2+ + OH ‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
Основания
Сильные (щелочи)
Слабые
Нерастворимы (искл. NH4OH)
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария
Источник: onlineclass.space
Гидроксид
2.jpg)
Основания — называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы — это ионы, которые имеют отрицательный заряд, в данном случае — это ионы OH — ). Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2). Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь.
Едкий натр, гидроксид натрия, натриевая щелочь, каустическая сода — всё это одно и тоже вещество, химическая формула которого NaOH. Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания, растворимые в воде, называют щелочью. К ним относятся гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой. Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).

Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH)2. Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор, при этом в растворе, где происходит электролиз, накапливается щелочь!
KCl + 2H2O →2KOH + H2 + Cl2 (эта реакция проходит при пропускании электрического тока через раствор).
Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет. Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода. Эта реакция ещё носит название — реакция нейтрализации
KOH + HCl → KCl + H2O
Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
Нерастворимые основания, в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
Cu(OH)2 + CuO → H2O
другие — даже при комнатной температуре (например, гидроксид серебра — AgOH).
Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
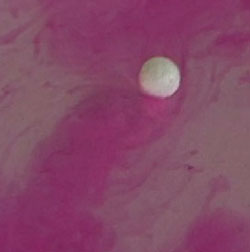
Щелочные металлы — такие металлы, которые при взаимодействии с водой образуют щелочь. К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности. Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH. Реакция протекает следующим образом:
Подобным образом ведут себя все щелочные металлы. Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) — Fe(OH)2 и (III) — Fe(OH)3. Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.

Гидроксид железа (II) — белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами. К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например

Перейти на английский
Bases. Properties of bases. Alkali
Источник: www.kristallikov.net