Оксид серебра (I) получают при нагревании серебра с кислородом или обработкой растворов АgNО3 щелочами:
Оксид серебра (I) в воде растворяется незначительно, тем не менее, вследствие гидролиза растворы имеют щелочную реакцию
в цианидных растворах превращается в комплекс:
Аg2О — энергичный окислитель. Окисляет соли хрома (III):
а также альдегиды и галогеноуглеводороды.
Окислительные свойства оксида серебра (I) обусловливают применение его суспензии как антисептического средства.
В электрохимическом ряду нормальных окислительно-восстановительных потенциалов серебро стоит после водорода. Поэтому металлическое серебро реагирует только с окисляющими концентрированной азотной и серной кислотами:
Большинство солей серебра мало или плохо растворимы. Практически нерастворимы галогениды, фосфаты. Плохо растворимы сульфат серебра и карбонат серебра. Растворы галогенидов серебра разлагаются под действием ультрафиолетовых и рентгеновских лучей:
2АgСl — h ν → 2Аg + Сl2
ПОЧЕМУ Я СЕРЕБРО И МЕДЬ НИКОГДА НЕ ПРОМЕНЯЮ НА ЗОЛОТО? СМОТРЕТЬ ВСЕМ !
Еще более чувствительны к действию ультрафиолетовых и рентгеновских лучей кристаллы АgСl с примесью бромидов. Под действием кванта света в кристалле протекают реакции
2АgВr → 2Аg 0 + Вr2
Это свойство галогенидов серебра используют при изготовлении светочувствительных материалов, в частности фотопленок, рентгеновских пленок.
Нерастворимые серебро хлорид и серебро бромид растворяются в аммиаке с образованием аммиакатов:
Растворение АgСl возможно потому, что ионы серебра связываются в очень прочный комплексный ион. В растворе остается настолько мало ионов серебра, что их не хватает для образования осадка, так как произведение концентраций меньше константы растворимости.
Бактерицидные свойства АgСl используются в препаратах для обработки слизистых оболочек газа. Для стерилизации и консервации пищевых продуктов применяется «серебряная вода» — обработанная кристаллами АgСl дистиллированная вода.
Так же, как и серебро, медь (I) образует нерастворимые галогениды. Эти соли растворяются в аммиаке и образуют комплексы:
Нерастворимы в воде оксиды и гидроксиды меди (II), которые имеют основной характер и растворяются в кислотах:
Образующийся аквакатион [Сu(Н2О)6] 2+ сообщает растворам яркую голубую окраску.
Гидроксид меди (II) растворяется в аммиаке, образует комплекс, окрашивающий раствор в синий цвет:
Эта реакция используется для качественной реакции на ионы меди (II).
Соли меди, серебра и золота взаимодействуют с сульфидами щелочных металлов и с водородсульфидом с образованием нерастворимых в воде осадков — Аg2S, Сu2S, СuS, Аu2S3.
Высокое сродство металлов группы IБ к сере определяет большую энергию связи М—S, а это, в свою очередь, обусловливает определенный характер их поведения в биологических системах.
Катионы этих металлов легко взаимодействуют с веществами, в состав которых входят группы, содержащие серу. Например, ионы Аg + и Сu + реагируют с дитиоловыми ферментами микроорганизмов по схеме:
6.8. Соединения меди, серебра, золота
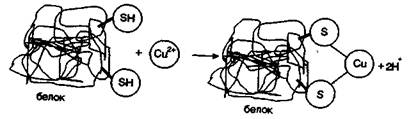
Включение ионов металлов в состав белка инактивирует ферменты, разрушает белки.
Такой же механизм лежит и в основе действия содержащих серебро и золото лекарственных препаратов, применяемых в дерматологии.
Наиболее распространенным соединением золота (III) является хлорид АuСl3, хорошо растворимый в воде.
Оксид и гидроксид золота (III) — амфотерные соединения с более выраженными кислотными свойствами. Гидроксид золота (III) в воде не растворяется, но растворяется в щелочах с образованием гидроксокомплекса:
Реагирует с кислотами с образованием ацидокомплекса:
Для золота и его аналогов известно большое число комплексных соединений. Знаменитая реакция растворения золота в «царской водке» (1 объем конц. НМОз и 3 объема конц. НСl) представляет собой образование комплексной кислоты:
В организме медь функционирует в степенях окисления + 1 и +2. Ионы Сu + и Сu 2+ входят в состав «голубых» белков, выделенных из бактерий. Эти белки имеют сходные свойства и называются азуринами.
Медь (I) более прочно связывается с серосодержащими лигандами, а медь (II) с карбоксильными, фенольными, аминогруппами белков. Медь (I) дает комплексы с координационным числом, равным 4. Образуется тетраэдрическая структура (если участвует четное число d-электронов). Для меди (II) координационное число равно 6, ему соответствует орторомбическая геометрия комплекса.
Источник: studopedia.su
Общая характеристика d-элементов группы 1 (медь, серебро, золото). Их степени окисления в соединениях. Химические свойства металлов. Оксиды. Гидроксиды, соли
ПОЛНЫЙ ОТВЕТ
Без воды — краткий вариант ответа,
легко понять и запомнить
НАВИГАЦИЯ ПО СТРАНИЦЕ


Окислительно-восстановительные потенциалы:
- φ°(Cu2+/Cu) = +0,34 В;
- φ°(Cu+ /Cu) = +0,52 В;
- φ°(Ag+ /Ag) = +0,80 В;
- φ°(Au3+/Au) = +1,45В;
- [Cu(CN)2]- + ē = Cu + 2CN-; φ° = –0,43В.
- 4Cu + O2 = 2Cu2O;
- 2Cu + O2 = 2CuO;
- 2Cu + O2 + H2O + CO2 = (CuOH)2CO3;
- 4Au + O2 + 8KCN + 2H2O = 4K[Au(CN)2] + 4KOH;
- 4Ag + O2 + 2H2S = 2Ag2S + 2H2O.
При нагревании:
- 2Cu + S = Cu2S,
- 2Ag + S = Ag2S,
- Cu + Cl2 = CuCl2,
- 2Ag + Cl2 = 2AgCl,
- 2Au + 3Cl2 = 2AuCl3,
- Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O,
- Ag + 2HNO3 = AgNO3 + NO2 + H2O,
- Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O,
- 2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O,
- 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O,
- Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O.
Гидроксиды меди, серебра и золота.
Cu(OH)2 cиний, а CuOH жёлтый.
- 2CuSO4 + H2CO + 5NaOH = 2CuOH + HCOONa + 2Na2SO4 + 2H2O,
- 2CuOH = Cu2O + H2O,
- CuSO4 + 2KOH = Cu(OH)2 + K2SO4,
- [Cu(NH3)4]SO4 + 2NaOH = Cu(OH)2 + Na2SO4 + 4NH3,
- Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4].
- Cu(OH)2 + H2SO4 = CuSO4 + 2H2O,
- 2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O,
- AuCl3 + NaOH = Au(OH)3 + 3NaCl,
- Au(OH)3 + NaOH = Na[Au(OH)4],
- Au(OH)3 + 4HCl = H[AuCl4] + 3H2O.
Соли.
CuSO4·5H2O — медный купорос (синий).
- [Cu(H2O)4] 2+ CuCl + 2Na2S2O3 = Na3[Cu(S2O3)2] + NaCl,
- CuCl + 2NH3 = [Cu(NH3)2]Cl,
- CuCl + HCl = H[CuCl2],
- CuCl + 2KCN = K[Cu(CN)2] + KCl,
- 4CuI + 5H2SO4(гор., конц.) = 4CuSO4 + 2I2 + H2S + 4H2O.
В насыщенном растворе:
- 2CuCl2 = Cu[CuCl4].
Купраты:
- 2CuO + Na2O2 = 2NaCuO2,
- 2Cu(OH)2 + Ba(OH)2 + NaOCl = Ba(CuO2)2 + NaCl + 3H2O,
- 2NaCuO2 + 8HCl = 2CuCl2 + 2NaCl + 4H2O + Cl2.
В ряду AgF, AgCl, AgBr, AgI растворимость в воде уменьшается.
Хлориды и бромиды серебра растворяются в аммиаке:
- AgCl + 2NH3 = [Ag(NH3)2]Cl,
- AgBr + 2NH3 = [Ag(NH3)2]Br.
AgI в аммиаке не растворяется.
- AgHlg + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaHlg
Источник: znzn.ru
Презентация на тему Общая характеристика элементов IБгруппы. Медь. Серебро. Золото


![Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I,](https://mypreza.com/img/tmb/2/108363/d63b9bbabac7db827cd44b06e280224a-720x.jpg)
















Слайд 1 Общая характеристика элементов IБ-группы. Медь. Серебро.Золото

Слайд 2 Элементы IБ-группы

Слайд 3 Элементы IБ-группы
Общая электронная формула:
[…] ns1 (n–1)d10
![Элементы IБ-группы Общая электронная формула:[…] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III](https://mypreza.com/img/tmb/2/108363/d63b9bbabac7db827cd44b06e280224a-720x.jpg)
Степени окисления: 0, +I, +II, +III
Слайд 4 Степени окисления

Слайд 5 Примеры устойчивых соединений

Слайд 6 Простые вещества

Слайд 7 В ЭХРН: …H . Cu …Ag …Au
ЭIБ

+ H2O ≠
ЭIБ + HАс ≠
CuAg
H2SO4(конц.) HNO3(конц.) HNO3(разб.)
Cu2+
Ag+
Слайд 8 Кислородные соединения Cu

Ag, Au
+I: Cu2O уст. красн.,
т. пл. 1240 °С
+II: CuO черн.,
разл. до Cu2O и O2 (1026 °С)
Cu(OH)2 синий, амфотерн., разл. до CuO и H2O (40-80 °С)
+III: Cu2O3
т-ра разл. 400 °С (до CuO и O2 )
+I: Ag2O разл. до Ag и O2 (160 °С )
+II: «Ag2O2» (AgIAgIIIO2) диамагнитен, разл. до Ag2O и O2 (100 °С)
+III: Au2O3 амфотерн., разл. до Au и O2 (160 °С)
Au2O3 · 2H2O амфотерный (Kк > Kо) – «золотая кислота»
Слайд 9
ЭIБ
C, H2, N2
Г2
CuCl CuF2 CuF CuCl2 CuI

CuI2
CuSO4 AgNO3 (кроме Au)
HNO3(конц. и разб.) H2SO4(конц.)
Смесь HNO3 и
HCl («царская водка»)
[AuCl4]–
OH–, окислитель, L (комплексо-образование)
[Cu(NH3)4]2+ [Cu(CN)2]− [Ag(CN)2]− [Au(CN)2]− и
Слайд 10 Распространение в природе и важнейшие минералы
В земной

коре:
26. Cu 0,01% масс.
69. Ag 1·10–5 % масс.
75. Au
5·10–5 % масс.
Слайд 11 Минералы
халькопирит (FeCu)S2
халькозин Cu2S
ковеллин CuS
куприт Cu2O
малахит Cu2(CO3)2(OH)2
аргентит Ag2S
хлораргирит

AgCl
калаверит AuTe2
Слайд 12 Добыча золота

Слайд 13 Серебро
Ag – уникальный элемент:
нет гидратов солей
нет аквакомплексов
Растворимые соли:

AgNO3, AgClO4, AgClO3, AgF
Комплексообразование (растворение осадка):
AgX(т) + 2NH3·H2O
=
= [Ag(NH3)2]X + 2H2O (КЧ 2)
AgX(т) + 2Na2SO3S =
Na3[Ag(SO3S)2] (КЧ 2)
Слайд 14 Серебро
2Ag+ + 2OH– ⮀ Ag2O(т) + H2O
ПР(AgOH) =

1,6 ·10–6
2Ag+ + S2– = Ag2S(т)
ПР(Ag2S) = 6,3
·10–50
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
(почернение
серебряных предметов)
Слайд 15 Галогениды серебра получают реакцией обмена. Все они кроме

AgF, плохо растворяются в воде. Нитрат серебра используется для
качественного определения ионов Cl-, Br-, I- в растворах:
Text
Text
Text
Слайд 16 При действии на растворимые соли серебра щелочей образуется

темный осадок оксида серебра
Оксид серебра растворяется в аммиаке
Сульфид серебра
не
растворим в обычных
кислотах
Слайд 17 Свойства золота
Не реагирует золото с водородом, азотом, фосфором,

углеродом, а галогены с золотом при нагревании образуют соединения:
AuF3, AuCl3, AuBr3 и AuI. Особенно легко, уже при комнатной
температуре, идет реакция с хлорной и бромной водой.
В быту опасность для золотых колец представляет иодная настойка – водно-спиртовый раствор иода и иодида калия:
2Au + I2 + 2KI = 2K[AuI2].
Слайд 18 Щелочи и большинство минеральных кислот на золото не

действуют. На этом основан один из способов определения подлинности
золота. Смесь концентрированных азотной и соляной кислот («царская водка») легко
растворяет золото:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O.
Слайд 19
химически чистого золота (по массе) в природном твердом растворе или
сплаве (изделии) выражается пробой. В международной практике применяются метрическая (в большинстве стран, в том числе и в России) и каратная системы проб.
Источник: mypreza.com