Электрохимический ряд активности металлов — это последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов.
| Металл | Электрохимический потенциал |
| Li | -3,0401 |
| Cs | -3,026 |
| Rb | -2,98 |
| K | -2,931 |
| Ra | -2,912 |
| Ba | -2,905 |
| Fr | -2,92 |
| Sr | -2,899 |
| Ca | -2,868 |
| Eu | -2,812 |
| Na | -2,71 |
| Sm | -2,68 |
| Md | -2,40 |
| La | -2,379 |
| Y | -2,372 |
| Mg | -2,372 |
| Ce | -2,336 |
| Pr | -2,353 |
| Nd | -2,323 |
| Er | -2,331 |
| Ho | -2,33 |
| Tm | -2,319 |
| Sm | -2,304 |
| Pm | -2,30 |
| Fm | -2,30 |
| Dy | -2,295 |
| Lu | -2,28 |
| Tb | -2,28 |
| Gd | -2,279 |
| Es | -2,23 |
| Ac | -2,20 |
| Dy | -2,2 |
| Pm | -2,2 |
| Cf | -2,12 |
| Sc | -2,077 |
| Am | -2,048 |
| Cm | -2,04 |
| Pu | -2,031 |
| Er | -2,0 |
| Pr | -2,0 |
| Eu | -1,991 |
| Lr | -1,96 |
| Cf | -1,94 |
| Es | -1,91 |
| Th | -1,899 |
| Fm | -1,89 |
| Np | -1,856 |
| Be | -1,847 |
| U | -1,798 |
| Al | -1,700 |
| Md | -1,65 |
| Ti | -1,63 |
| Hf | -1,55 |
| Zr | -1,53 |
| Pa | -1,34 |
| Ti | -1,208 |
| Yb | -1,205 |
| No | -1,20 |
| Ti | -1,19 |
| Mn | -1,185 |
| V | -1,175 |
| Nb | -1,1 |
| V | -0,87 |
| Cr | -0,852 |
| Zn | -0,763 |
| Cr | -0,74 |
| Ga | -0,560 |
| Fe | -0,441 |
| Cd | -0,404 |
| In | -0,3382 |
| Tl | -0,338 |
| Co | -0,28 |
| In | -0,25 |
| Ni | -0,234 |
| Mo | -0,2 |
| Sn | -0,141 |
| Pb | -0,126 |
| H2 | |
| W | +0,11 |
| Ge | +0,124 |
| Sb | +0,240 |
| Ge | +0,24 |
| Re | +0,300 |
| Bi | +0,317 |
| Cu | +0,338 |
| Po | +0,37 |
| Тс | +0,400 |
| Ru | +0,455 |
| Cu | +0,522 |
| Te | +0,568 |
| Rh | +0,600 |
| W | +0,68 |
| Tl | +0,718 |
| Rh | +0,758 |
| Po | +0,76 |
| Hg | +0,7973 |
| Ag | +0,799 |
| Pb | +0,80 |
| Os | +0,850 |
| Hg | +0,851 |
| Pt | +0,963 |
| Pd | +0,98 |
| Ir | +1,156 |
| Au | +1,498 |
| Au | +1,691 |
Трансмутация — получение золота из меди.
На этой странице в табличной форме представлена информация о ряде химической активности металлов. Таблицу электрохимической активности металлов используют инженеры-химики для выполнения необходимых прикладных расчетов в науке и производстве.
Источник: www.center-pss.ru
Элементы 1 Б группы медь серебро золото Сопоставление

Элементы 1 Б группы: медь, серебро, золото. Сопоставление электронных конфигураций, величин радиусов, энергии ионизации, характерных степеней окисления и координационных чисел атомов элементов I A и I Б групп. Физические, химические свойства, получение и применение простых веществ.
Сопоставление строения и свойств однотипных соединений (оксиды, гидроксиды, галогениды) элементов I A и I Б групп со степенями окисления (I). Особенности соединений Cu (II). Комплексные соединения (аммиакаты, цианиды, галогениды): координационные числа, зависимость формы координационного полиэдра от электронной конфигурации центрального атома и природы лиганда. Строение и свойства соединений элементов Сu, Ag, Аu в высших степенях окисления. Высокотемпературные сверхпроводники на основе сложных оксидов меди.

Характеристика элементов IБ группы. ●Сравнительно малая химическая активность элементов подгруппы меди объясняется двумя причинами: Во-первых, ярко выраженным в их атомах эффектом проникновения s-электронов внутрь непосредственно подстилающих (n-1)d-оболочек. Во-вторых, в результате d-контракции и совместной d- и fконтракций(золото) радиусы их атомов значительно меньше радиусов атомов щелочных металлов R(K)>R(Cu) R(Rb)>R(Ag) R(Cs)>R(Au). ●В результате металлы подгруппы меди характеризуются несравненно большими значениями первого ионизационного потенциала, ОЭО, сродства к электрону, чем щелочные металлы.

Cu-медь. Общая характеристика. ●Элемент медь расположен в IV периоде и IБ группе, атомный номер 29, относительная атомная масса 63, 546. ●Электронная конфигурация меди в основном состоянии 1 s 22 p 63 s 23 p 63 d 104 s 1 ( в атоме меди наблюдается «проскок» электрона с 4 s-подуровня на 3 dподуровень ). ●Следовательно, в атоме меди третий энергетический уровень полностью заполнен электронами. Поскольку в степени окисления +2 медь имеет не полностью заполненный энергетический 3 d-подуровень( 3 d 9), она, подобно железу и хрому, относится к семейству dэлементов.
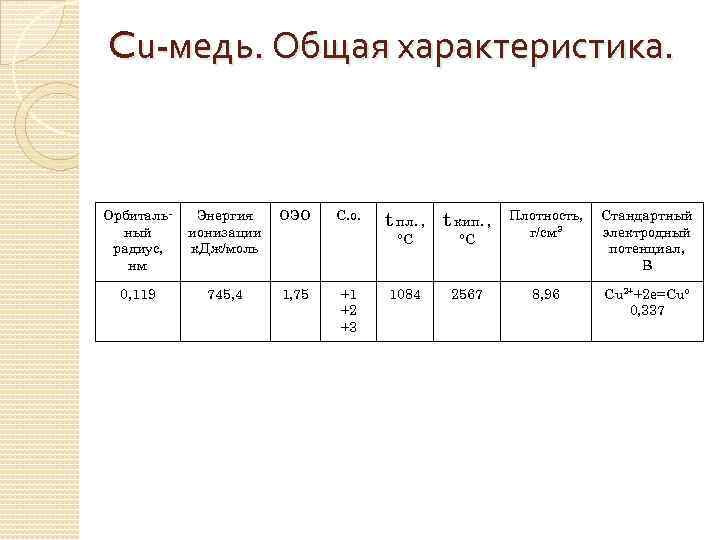
Cu-медь. Общая характеристика. Орбитальный радиус, нм Энергия ионизации к. Дж/моль ОЭО 0, 119 745, 4 1, 75 С. о. t пл. , t кип. , °С +1 +2 +3 °С 1084 2567 Плотность, г/см 3 Стандартный электродный потенциал, В 8, 96 Cu 2++2 e=Cu° 0, 337

Cu-медь. Общая характеристика. ●В природе медь встречается в виде соединений(чаще): Cu 2 S — медный блеск, Cu. Fe. S 2 — медный колчедан, Cu 2 O — куприт, Cu 2(OH)2 CO 3 — малахит, и в виде простого вещества( самородная медь).

Физические свойства меди. ●Простое вещество медь – металл красного цвета, ковкий, обладает прекрасной тепло- и электропроводностью ( уступает серебру), малая твердость, но легко устраняется добавлением других металлов. Медь относится к группе тяжелых тугоплавких металлов. ●Кристаллическая медь имеет кубическую гранецентрированную решетку. ●Химическая активность меди не велика. В ряду стандартных электродных потенциалов медь расположена за водородом, поэтому наиболее эффективно медь окисляется не водородом, а анионом кислот-окислителей (HNO 3 , H 2 SO 4(конц. )). Разбавленные растворы кислотнеокислителей, щелочей(в отсутствие окислителей) на медь не действуют.

Физические свойства меди. ●Вследствие окисления на воздухе в присутствии углекислого газа медные изделия со временем покрываются зеленым налетом карбоната гидроксомеди (II) (Cu. OH)2 CO 3.

Химические свойства меди. ●При температуре красного каления медь реагирует с кислородом с образованием оксида меди (II), а при более высокой температуре –оксид меди(I). 2 Cu + O 2 = 2 Cu. O (черный) — оксид меди (II) 4 Cu + O 2 = 2 Cu 2 O (красный) — оксид меди(I) ●С галогенами медь реагирует при нагревании, во всех случаях кроме йода образуются галогениды меди (II). Cu + Cl 2 = Cu. Cl 2 2 Cu + I 2 = 2 Cu.
I ●При нагревании медь реагирует с серой, состав продукта зависит от температуры, как в случае с кислородом. Cu + S = Cu. S (сульфид меди (II)) 2 Cu + S = Cu 2 S (сульфид меди(I)) ●C азотом, водородом, углеродом медь не реагирует. ●С фосфором и кремнием реагирует при нагревании. 2 Cu + P = Cu 2 P ( а также Сu 3 P 2, Cu 3 P) 2 Cu + Si = Cu 2 Si ( а также соединения другого состава)

Химические свойства меди. ●Медь хорошо растворяется в азотной и серной концентрированной кислотах. Cu + 4 HNO 3(>60%) = Cu(NO 3)3 + 2 NO 2 + 2 H 2 O ( t° ) 3 Cu + 8 HNO 3(40%) = 3 Cu(NO 3)3 + 2 NO + 4 H 2 O ( t° ) Cu + 2 H 2 SO 4(конц. ) = Cu. SO 4 + SO 2 + 2 H 2 O ●C разбавленными галогеноводородными кислотами медь не реагирует, однако растворяется в их концентрированных растворах. 2 Cu + 4 HCl(конц. ) = H 2 + 2 H[Cu.
Cl 2] (дихлорокупрат (I) водорода) ●При нагревании медь реагирует с сероводородом. 2 Сu + H 2 S = Cu 2 S + H 2 ●При обычной температуре медь окисляется оксидом азота(IV), а при нагревании оксидом азота (II). 2 Cu + NO 2 = Cu 2 O + NO 4 Cu + 2 NO = Cu 2 O + N 2 ●Нагретая до красного каления, медь реагирует с аммиаком, образуя нитриды меди (I). 6 Cu + 2 NH 3 = 2 Cu 3 N + 3 H 2

Химические свойства меди. ●Медь вытесняет менее активные металлы из водных растворов солей. Cu + 2 Ag. NO 3 = Cu(NO 3)2 + 2 Ag ●В растворимое состояние медь можно перевести с помощью водного раствора Fe. Cl 3, поскольку ионы Fe 3+ окисляют металлическую медь. Cu + 2 Fe.
Cl 3 = Cu. Cl 2 + 2 Fe. Cl 2 ●В присутствии кислорода медь растворяется в конц. водных растворах аммиака с образованием ярко-синего тетраамминового комплекса. 2 Cu + 8 NH 3· H 2 O + O 2 = 6 H 2 O + 2[Cu(NH 3)4](OH)2 (гидроксид тетрааммин меди (II))

Применение меди. ●В следствие высокой тепло- и электропроводности медь в больших количествах используется для изготовления электрических проводов, кабелей, котлов, перегонных кубов и т. д. ●Самое разнообразное применение находят сплавы меди. Латунь(содержит до 45% цинка) используется для изготовления радиаторов, деталей часовых механизмов, в судостроении.
Медноникелевые сплавы применяются в энергетической промышленности, судостроении, для изготовления термопар. Основное назначение бронзы(содержит олово и алюминий) – изготовление колов и статуй. Cu 2 O – в качестве выпрямителя переменного тока. Cu. O – как окислитель в лабораторной технике, в производстве стекла и эмалей, как зеленый и синий краситель. Cu.
SO 4 – как осушитель. Cu. SO 4 · 5 H 2 O – для борьбы с вредителями с/х, при пропитке древесины для предотвращения гниения. (Cu. OH)2 CO 3 – для изготовления синих и зеленых красок, как поделочный камень( в виде малахита).

Cu 2 O ●Твердое вещество красного цвета, в природе встречается в виде минерала куприта. ●Оксид практически не растворим в воде, обладает слабовыраженными амфотерными свойствами( преобладают основные), растворяется в кислотах и концентрированных растворах щелочей при нагревании. Cu 2 O + 4 HCl = 2 H[Cu. Cl 2] + H 2 O Cu 2 O + H 2 SO 4 = Cu. SO 4 + H 2 O + Cu Cu 2 O + 2 Na.
OH(конц. ) + H 2 O = 2 Na[Cu(OH)2] (дигидроксокупрат(I) натрия) ●Оксид хорошо растворяется в водных растворах аммиака с образованием комплексных соединений (аммиакатов), координационное число Cu равно 2. Cu 2 O + 4 NH 3 + H 2 O = 2[Cu(NH 3)2]OH (гидроксид диаммин меди (I)) ●Cu 2 O + H 2 = 2 Cu + H 2 O (t°) ●Cu 2 O + CO = 2 Cu + CO 2 (t°) ● 2 Cu 2 O + 2 Al = 6 Cu + Al 2 O 3 (t°) ● 2 Cu 2 O + O 2 = 4 Cu. O (t°) ● 2 Cu 2 O = 4 Cu + O 2 (t°) ●Cu 2 O можно получить, обрабатывая при слабом нагревании глюкозу свежеполученным гидроксидом меди(II). 2 Сu(OH)2+C 6 H 12 O 6=CH 2 OH-(CHOH)4 -COOH+Cu 2 O +2 H 2 O (t°)

Cu. O ●Твердое вещество черного цвета, плохо растворяется в воде, встречается в природе в виде минерала мелаконита. ●Оксид обладает слабовыраженными амфотерными свойствами( преобладают основные), хорошо растворяется в кислотах, а в щелочах только при сплавлении. Cu. O + H 2 SO 4 (разб. ) = Cu. SO 4 + H 2 O (t°) Cu. O + 2 KOH = H 2 O + K 2 Cu.
O 2 (купрат калия) (t°) ●Оксид образует комплексные соединения, координационное число 4. Cu. O + 4 NH 3 + H 2 O = [Cu(NH 3)4](OH)2 ( гидроксид тетрааммин меди (II)) ●Cu. O + CO = Cu + CO 2 (t°) ●Cu. O + C = Cu + CO (t°) ● 4 Cu. O = 2 Cu 2 O + O 2 (t°) ●Получение при нагревании 2 Сu+O 2=2 Cu.
O Cu(OH)2=Cu. O+H 2 O 2 Cu(NO 3)2=2 Cu. O+4 NO 2 +O 2
Источник: present5.com
Химическая активность меди выше чем у золота


webkonspect.com — сайт, с элементами социальной сети, создан в помощь студентам в их непростой учебной жизни.
Здесь вы сможете создать свой конспект который поможет вам в учёбе.
Чем может быть полезен webkonspect.com:
- простота создания и редактирования конспекта (200 вопросов в 3 клика).
- просмотр конспекта без выхода в интернет.
- удобный текстовый редактор позволит Вам форматировать текст, рисовать таблицы, вставлять математические формулы и фотографии.
- конструирование одного конспекта совместно с другом, одногрупником.
- webkonspect.com — надёжное место для хранения небольших файлов.
Обзор сайта:
Источник: webkonspect.com