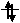Электронные семейства размещаются по периодам и группам. Элементы семейств лантана и актиния ( f, rf — семейства) числом 14 должны бы все вместе занять клетки в III группе 6-го и 7-го периодов, однако они обычно выносятся в отдельные графы как внегрупгювые элементы. [2]
К какому электронному семейству принадлежит соответствующий элемент. [3]
К какому электронному семейству относится каждый из этих элементов. [4]
К каким электронным семействам относятся элементы-металлы. [5]
К какому электронному семейству относится этот элемент. [6]
В нечетных периодах новые электронные семейства не возникают. График выражает собой одну из фундаментальных закономерностей, лежащих в основе периодической системы в целом. [7]
Период содержит четыре электронных семейства . [8]
Число элементов, образующее данное электронное семейство , указывается числом, записанным надстрочно при буквенных обозначениях типа семейства. Например, запись 5 / 1 в таблице говорит о том, что 5 rf — семейство состоит из десяти элементов. Это отвечает электронной емкости соответствующею подуровня. [9]
Как получить ЗОЛОТО дома? Для каждого ШКОЛЬНИКА…ЛЕГКО
Указать, к какому электронному семейству относится каждый из перечисленных элементов. [10]
Все элементы разделяются на 4 электронных семейства . [11]
Переходные элементы относятся к d — электронным семействам . Они достраивают d — подуровень предпоследней оболочки. В периодической системе ( см. табл. 5.4) переходные элементы находятся в подгруппах Ilia — Vila и VIII. К ним также относятся элементы 16 и Пб подгрупп, хотя их rf — оболочки заполнены. Все переходные элементы являются металлами. [12]
Чем определяется принадлежность элементов к s — электронному семейству . В каких группах и подгруппах периодической системы Д. И. Менделеева они находятся. Назовите те из них, которые в виде простого вещества являются металлами и неметаллами. [13]
По способу заполнения электронных оболочек атомов различают четыре электронных семейства элементов : s — элементы, р-элементы, d — элементы и / — элементы. Эта система отражает все особенности в строении электронных оболочек атомов элементов. Свойства s -, p -, d — элементов и их соединений рассмотрим в плане таблицы Менделеева. [14]
Как видно, первый период ( сверхмалый) содержит только одно электронное семейство элементов , второй и третий ( малые периоды) — по два, четвертый и пятый ( большие периоды) — по три, а шестой и седьмой ( сверхбольшие периоды) — по четыре семейства. При этом седьмой период недостроен: атом последнего недавно открытого элемента 104 ( курчатовия) содержит только два с ( — электрона ( 6d2) из десяти возможных, а 7р — семейство полностью отсутствует. [15]
Источник: www.ngpedia.ru
2.8. Электронные семейства элементов
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
ХЛЕБ: История Зерна / Простовещи / МИНАЕВ
s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными 1 являютсяs-электроны внешнего уровня.
p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов.Например:
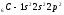
;
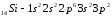
.
Элементы с одинаковым строением внешнего и предвнешнего энергетических уровней называют полными электронными аналогами.Например:
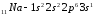
;
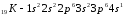
.
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было открытие периодического закона, сделанное в 1869 г. гениальным русским ученым Д. И. Менделеевым. Периодический закон в формулировке Д. И. Менделеева гласит: “ свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса”.
Графическим выражением этого закона стала созданная им периодическая система элементов.
В настоящее время известно несколько сотен вариантов периодической системы элементов, но все они в своей основе содержат предложенные Менделеевым принципы её построения. Наибольшее распространение получили короткая (восьмиклеточная) и длинная (тридцатидвухклеточная) формы периодической система элементов.
Развитие учения о строении атома вскрыло глубокий физической смысл периодического закона. Как было доказано, свойства элементов зависят, прежде всего, от заряда атомных ядер, который в свою очередь определяет распределение электронов на электронных оболочках атомов.
Основной характеристикой атома является положительный заряд ядра, численно равный порядковому номеру элемента. В нейтральном атоме заряд ядра и общее число электронов равны. Распределением электронов на электронных оболочках атомов определяются свойства элементов и их соединений, положение элемента в периодической системе. Периодичность изменения свойств химических элементов и их соединений зависит от периодически повторяющейся сходной структуры электронных оболочек атомов.
В 1913 г. ученик Резерфорда английский ученый Мозли, исследуя спектры лучей Рентгена для различных элементов, установил простое соотношение между длиной волны рентгеновских лучей и порядковым номером элемента (закон Мозли):
Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента, т. е.
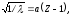
где – длина волны; Z – порядковый номер элемента; – постоянная, одинаковая для всех элементов.
Из уравнения следует, что, зная и измерив , можно вычислить порядковый номер элемента. Это экспериментальный метод проверки правильности распределения элементов в периодической системе по возрастанию заряда ядра. Закон Мозли показал, что Д.И. Менделеев правильно расположил элементы в периодической системе, позволил установить общее число элементов в каждом периоде, а главное, направил усилия ученых на открытие предсказанных им элементов. Вскоре несколько элементов было открыто с помощью анализа рентгеновских спектров (гафний, Z=72; рений, Z=75 и др.).
Вместе с тем из закона Мозли следует, что порядковый номер – это не простая нумерация элементов, а выражение конкретного внутреннего свойства атома – величины элементарных положительных зарядов ядра. Именно положительный заряд ядра (а не атомная масса) является главной характеристикой атома.
В свете современных представлений о строении атома изменилась и формулировка периодического закона: свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер.
Источник: studfile.net
Электронные формулы атомов элементов серы и железа
Задание 22.
Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nl x где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→
→6d→7p.
Так как число электронов в атоме элемента равно его порядковому номеру в таблице химических элементов Д. И. Менделеева, то для элементов №16 (сера) и №26 (железо) электронные формулы имеют вид:
+16S1s 2 2s 2 2p 6 3s 2 3p 4 ; +26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника  , кружочка
, кружочка  или линейки
или линейки  , а электроны в этих ячейках обозначают стрелками
, а электроны в этих ячейках обозначают стрелками  . В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например
. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например