Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
Габриелян химия 8 кл решение задачи 4 стр 149
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
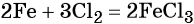
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
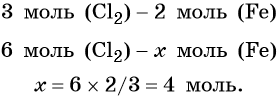
Определяем массу железа:
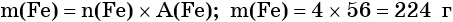
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
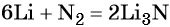
Определяем количество вещества азота, вступившего в реакцию:
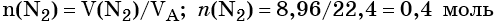
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
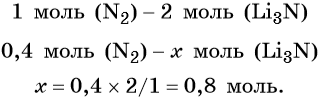
Определим массу Li3N:
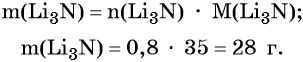
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
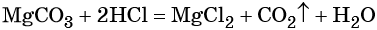
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
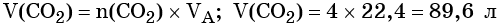
Обвал ЗЕМЛИ! И перед ГЛАЗАМИ… ЭТО стоило ПЕРЕЖИТЬ и ВЫБРАТЬСЯ…
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
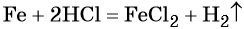
Определим количество вещества железа:
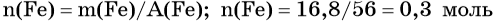
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
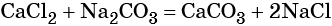
Согласно уравнению химической реакции составим пропорцию и решим её:
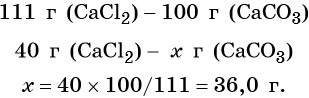
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
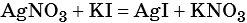
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
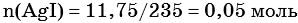
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
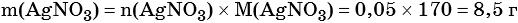
3) Вычислена массовая доля нитрата серебра в исходном растворе:
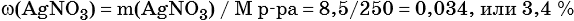
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Источник: himi4ka.ru
Как определить количество вещества золота и серебра
Вопрос по химии:
Определите количество вещества золота и серебра , которое содержится в обручальном кольце массой 3,75 г. и пробой 585 .
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 27.02.2017 09:57
- Химия
- remove_red_eye 10221
- thumb_up 28
Ответы и объяснения 1
Масса золота, содержащегося в кольце составляет: 3,75*58,5/100=2,19 г
Масса серебра, содержащегося в кольце: 3,75-2,19=1,56 г
- 28.02.2017 20:03
- thumb_up 33
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник: online-otvet.ru
Определите количество золота серебра которое
Определите количество золота и серебра, которое содержится в обручальном кольце массой 3, 75 г пробой 585?
Определите количество золота и серебра, которое содержится в обручальном кольце массой 3, 75 г пробой 585.

Изделие с пробой 585 содержит 58, 5% золота и 100 — 58, 5 = 41, 5% серебра.
Масса золота, содержащегося в кольце составляет : 3, 75 * 58, 5 / 100 = 2, 19 г
Масса серебра, содержащегося в кольце : 3, 75 — 2, 19 = 1, 56 г.

Определите в какой порции вещества содержится больше атомов в 1 г?
Определите в какой порции вещества содержится больше атомов в 1 г.

Для изготовления обручального кольца массой 5, 5 г взяли 3, 2 г золота, 0, 4 г серебра и 1, 9 г меди?
Для изготовления обручального кольца массой 5, 5 г взяли 3, 2 г золота, 0, 4 г серебра и 1, 9 г меди.
Какой пробы будет кольцо, если пробу выражают числом весовых частей драгоценного металла в 1000 частях сплава?

Золото 585 пробы содержит 41, 5% меди?
Золото 585 пробы содержит 41, 5% меди.
Сколько граммов чистого золота содержит кольцо этой пробы, имеющее массу 2, 8?

Золото пробы 585 содержит 58?
Золото пробы 585 содержит 58.
5% этого металла, остальное медь.
Какое количество вещества и сколько граммов золота содержит кольцо из металла, этой пробы массой 4, 7 грамм?

Юный химик Вася однажды решил проверить взаимодействие металлов с азотной кислотой?
Юный химик Вася однажды решил проверить взаимодействие металлов с азотной кислотой.
В качестве металлов он использовал золотое кольцо мамы весом 0, 9г.
Проба на золотом изделии означает количество грамм золота в 1000г этого изделия.
В качестве лигатуры (добавок) в “красное” золото добавляют в основном медь и серебро.
Поскольку Вася хорошо знал химию и маму, которая будет недовольна пропажей своего украшения, он выбрал самое дешевое кольцо красноватого оттенка и пробой 353.
После чего он опустил кольцо в концентрированную азотную кислоту и наблюдал его растворение и выделение бурого газа.
После окончания реакции Вася с удивлением обнаружил, что кольцо растворилось не полностью.
Какой металл остался на дне сосуда и какова была его масса, если принять, что кольцо состояло только из золота, серебра и меди?

1) Золото пробы 585 содержит 58, 5% этого металла, остальное — медь?
1) Золото пробы 585 содержит 58, 5% этого металла, остальное — медь.
Какое количество вещества и сколько граммов золота содержит кольцо из металла этой пробы массой 4, 7г ?
2) В 250 мл воды растворили 67, 2 (н.
Какова массовая доля соляной кислоты в полученном растворе?

ПОМОГИТЕ СРОЧНО ПОЖАЛУЙСТА?
ПОМОГИТЕ СРОЧНО ПОЖАЛУЙСТА!
1. Найти массу 0, 5 моль фосфорной кислоты Н3РО4.
2. Сколько молекул содержится в 60 моль вещества?
3. Рассчитайте количество (моль) вещества, содержащееся в 540 г.
4. Сколько атомов золота содержится в среднем обручальном кольце, массой 1, 97 грамма?
Пронумеровайте свои ответы на вопросы пожалуйста.

Чему равно количество вещества золота в обручальном кольце пробы 583′ массой 4, 0 г?
Чему равно количество вещества золота в обручальном кольце пробы 583′ массой 4, 0 г?
Пожалуйста, оформите в виде задачи с правильным оформлением.

Определить пробу золотого кольца, если в кольце массой 12г содержится 40% меди и 22, 5% серебра?
Определить пробу золотого кольца, если в кольце массой 12г содержится 40% меди и 22, 5% серебра.
Найти массу всех металлов, которые содержатся в кольце.

Определите в какой порции вещества содержиться больше атомов?
Определите в какой порции вещества содержиться больше атомов?
В 1 г серебра или в 1 г золота!
На этой странице сайта вы найдете ответы на вопрос Определите количество золота и серебра, которое содержится в обручальном кольце массой 3, 75 г пробой 585?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов.
Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.


Дано : m(H₂O) = 500 гt = 70°CНайти : m(Ba(NO₃)₂) — ? Решение. При данной температуре (70°С) в 100 г воды растворяется 20 г нитрата бария, составим пропорцию : 100 г Н₂О — 20 г (Ba(NO₃)₂)500 г Н₂О — х г (Ba(NO₃)₂)х = m(Ba(NO₃)₂) = 500 * 20 / 100 = 1..

Исходный раствор содержит 400 * 1, 1 * 0, 2 = 88 граммов HCl. Чтобы получить 36, 5% — ный раствор (массовая доля равна 0, 365), нужно прибавить (400 * 1, 1 * 0, 365 — 88) : (1 — 0, 365) = 114, 33 грамма, или 114, 33 * 22, 4 : 36, 5 = 70, 2 дм³ чисто..

6co2 + 6h2o = c6h12o6 + 6O2(энергия солнца т. Е. фотосинтез) с6h12o6 = c6h10o5 + h2o c6h10o5 + 6O2 = 6co2 + 5h2o.

H2SO4(т) + 2 NaCl(т) — > Na2SO4(т) + 2HCl(газ).

Количество протонов равно порядковому номеру элемента. Значит, элемент имеет номер 16. Это сера.

1. Какие способы получения водорода используют в промышленности? В промышленности водород получают : 1) обработкой раскаленного угля водяным паром в специальных аппаратах — газогенераторах. В результате взаимодействия водяного пара с углеродом обра..

В полиэфир предварительно вводят небольшое количество воды. При последующем смешении полиэфира с диизоцианатом одновременно идет образование полиуретана и выделение газа за счет реакции изоцианатных групп с водой : R – N = C = O + H2O = R — NH2 + CO..

NaCl2 CUO AlS AlCl2 H2O LiNa2 AlH2.

С6Н5ОН + 2Na = C6H5ONa + H2 соотношение количеств вещества фенола, натрия и водорода1 : 2 : 1 по уравнению. Найдем это соотношение по условию. N = m : M ; n = V : Vm. N(C6H5OH) = 20 : 94 = 0, 2моль. N(Na) = 4, 6 : 23 = 0, 2моль.
Из этих данных в..
Определите количество золота серебра которое
Определите количество золота и серебра, которое содержится в обручальном кольце массой 3,75 г пробой 585
Ответы и объяснения 1
Масса золота, содержащегося в кольце составляет: 3,75*58,5/100=2,19 г
Масса серебра, содержащегося в кольце: 3,75-2,19=1,56 г
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Определите количество вещества золота и серебра, которое содержится в обручальном кольце массой 3,75 г и пробой 585 градусов .
Масса золота, содержащегося в кольце составляет: 3,75*58,5/100=2,19 г
Масса серебра, содержащегося в кольце: 3,75-2,19=1,56 г
соли аммония→ аммиачная вода→ аммиак→соли аммония
азот→оксид азота(ll)→оксид азота(IV)→азотистая кислота→нитриты
оксид азота(ll)→оксид азота(IV) →азотная кислота→оксид азота(ll)
оксид азота(IV)→нитраты→азотная кислота
4NO₂ + O₂ + 2Ba(OH)₂ = 2Ba(NO₃)₂ + 2H₂O
4P + 6O₂= 2P₂O₅ оксид фосфорф(V)
P₂O₅ + H₂O = 2HPO₃ метафосфорная кислота
HPO₃+NaOH=NaPO₃+H₂O метафосфат натрия
P₂O₅+3H₂O=2H₃PO₄ фосфорная кислота
2H₃PO₄=H₄P₂O₇+H₂O дифосфорная кислота
H₃PO₄+3NaOH=Na₃PO₄+3H₂O фосфат натрия
2Ca₃(PO4)₂ + 10C (кокс) + 6SiO₂ = 6CaSiO₃ + P₄ + 10CO фосфор
Насколько помню это делается по ряду напряжения металлов. Калий щелочной очень активный металл реагирует и с холодной. Магний стоит чуть дальше поэтому с горячей. Цинк амфотерный еще дальше значит с парами. И все что в ряду дальше водорода с водой вообще не взаимодействует -медь.
Источник: ollimpia.ru