Коллоидная химия («коллоид» – от греческого κόλλα – клей) – наука, изучающая физико-химические свойства гетерогенных высокодисперсных систем и ВМВ в твердом состоянии и в растворах. Коллоидный раствор золота
- Главная
- Медицина
- Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1)
Слайды и текст этой презентации
Слайд 1Коллоидные растворы (часть 1)
Основные понятия. Классификация дисперсных
систем.
2. Методы получения коллоидных растворов.
3. Методы очистки
коллоидных растворов.
4. Строение мицеллы гидрофобных систем.
5. Электрокинетический потенциал.
Изоэлектрическое состояние мицеллы.
Лектор: Ирина Петровна Степанова, доктор биологических наук, профессор, зав. кафедрой химии
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ

Золото из грязного раствора. Магний в помощь)
Слайд 2
Коллоидная химия («коллоид» – от греческого
κόλλα – клей) – наука, изучающая физико-химические
свойства гетерогенных высокодисперсных систем и ВМВ в твердом состоянии и в растворах.
Коллоидный раствор золота (экспонат музея Фарадея в Королевском институте)

Слайд 3История развития коллоидной химии
Томас Грэм (Грэхэм)
английский/шотладский
химик
впервые использовал термин
«коллоид» для описания
растворов
с необычными
свойствами.
В развитие этой науки
внесли вклад Т. Юнг,
П. Лаплас, Д. Гиббс,
Г. Гельмгольц, Д. Рэлей
И. Ленгмюр и др.
Т. Грэм (1805-1869)

Слайд 4История развития коллоидной химии
Николай Петрович Песков —
основатель современной коллоидной химии как науки о
поверхностных явлениях и дисперсных системах.
Ввел понятие об агрегативной и седиментационной устойчивости дисперсных систем.
Н. П. Песков (1880-1940)

Слайд 5Медико-биологическое значение темы

Слайд 6Медико-биологическое значение темы
Извлечение золота из горной породы аптечным йодом!

Слайд 7Медико-биологическое значение темы

Слайд 8
В любом животном или растительном
организме представлены
практически
все коллоидные дисперсные системы:
как лиофильные,
так и лиофобные,
связаннодисперсные и
свободнодисперсные.
«Человек – это ходячий коллоид» И.И. Жуков
Медико-биологическое значение темы

Слайд 9Медико-биологическое значение темы

Слайд 10.
Медико-биологическое значение темы
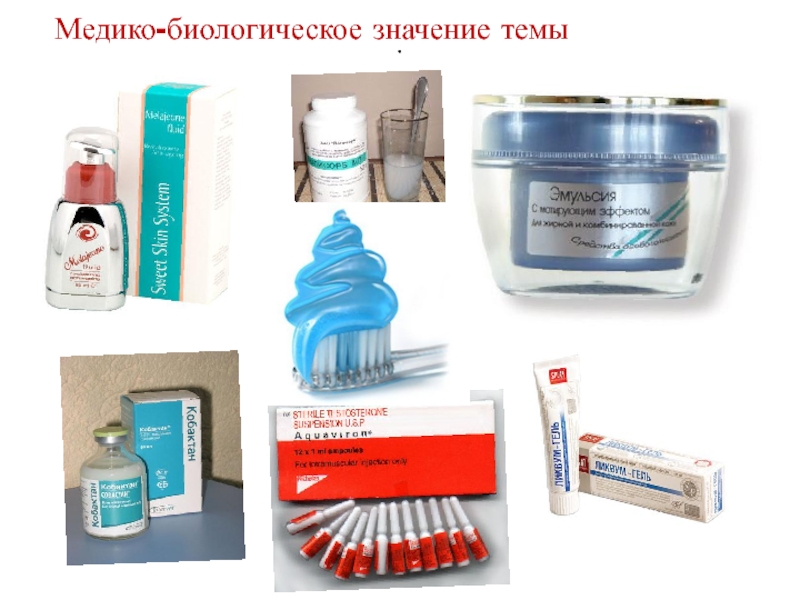
Слайд 11Бактерицидная активность коллоидного раствора серебра
a – клетка
E.Coli
b – клетка E.Coli, подвергнутая воздействию
наночастиц серебра
Медико-биологическое значение темы
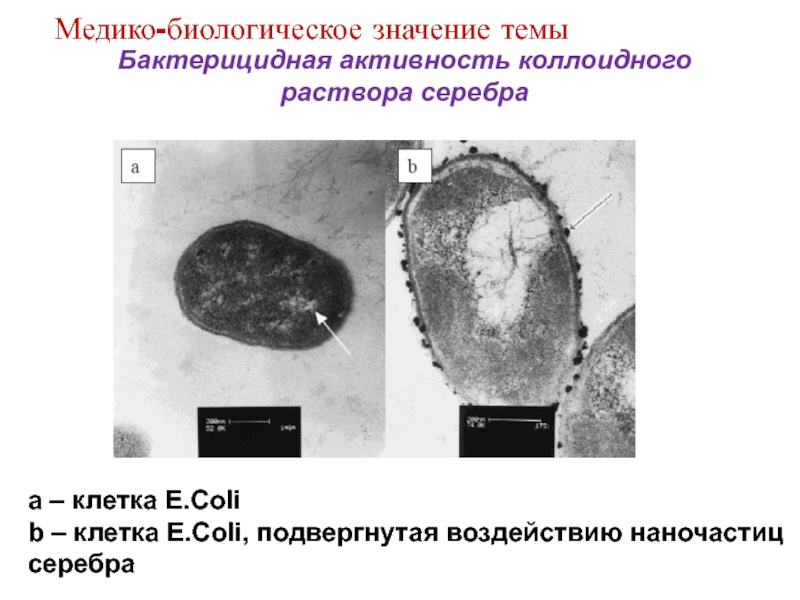
Слайд 12 Бактерицидная активность коллоидного раствора серебра
Популяции of Listeria
После
обработки
через 1.5 часа
До обработки
Медико-биологическое значение темы
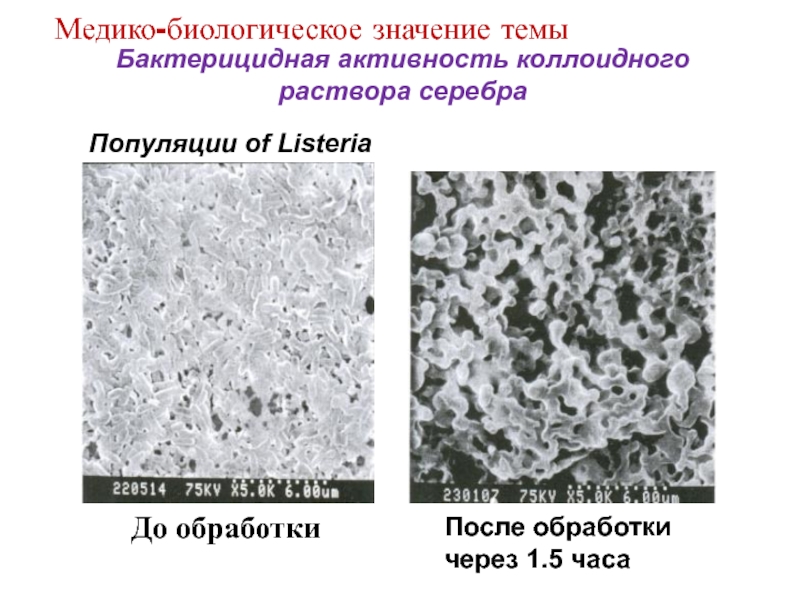
Слайд 13Бионаноматериалы
Клетки костной ткани на пористом кремнии
Сшитые
ферменты
Медико-биологическое значение темы
Реагент
Продукт
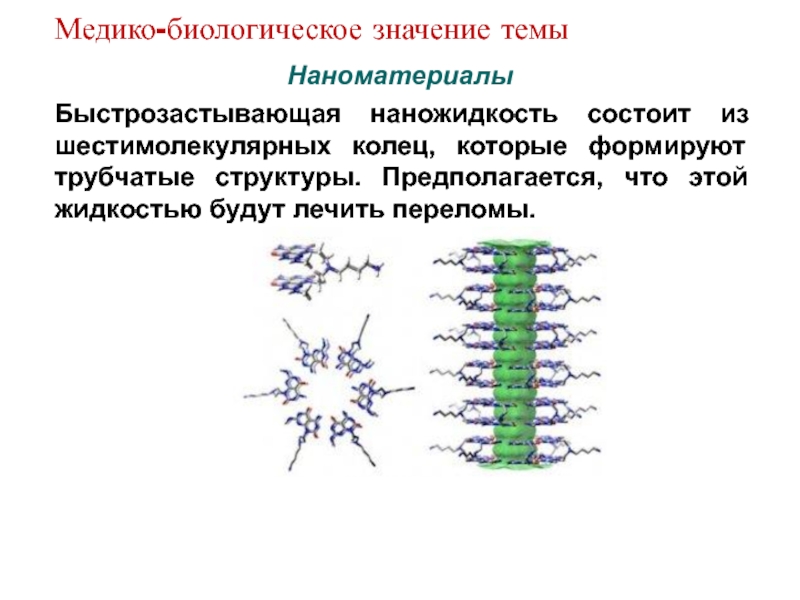
Слайд 14Наноматериалы
Быстрозастывающая наножидкость состоит из шестимолекулярных колец, которые
формируют трубчатые структуры. Предполагается, что этой жидкостью
будут лечить переломы.
Медико-биологическое значение темы
Слайд 15Основные понятия
Два общих признака дисперсных систем: гетерогенность и
дисперсность.
Дисперсной системой (ДС) называется система,
в которой одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества.

Слайд 16
Классификация дисперсных систем
Дисперсная фаза (ДФ)
представляет собой частицы, а дисперсионная среда (ДСр)
— сплошная среда, в которой находится раздробленая дисперсная фаза.
Степень дисперсности (D) определяется величиной, обратной диаметру частиц (d): D = 1 / d.

Слайд 17
Дисперсные системы
Дисперсная фаза
Дисперсионная
среда
Поверхность раздела фаз
Пример: система
— глина в воде.
Глина — ДФ, вода — ДСр.

Слайд 18
Коллоидный раствор серебра
Основные понятия. Классификация дисперсных
систем

Слайд 19
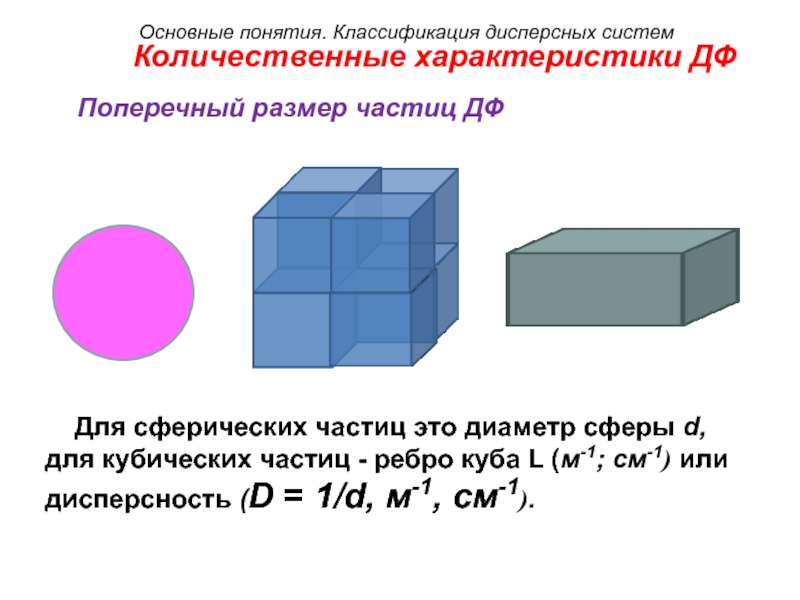
Количественные характеристики ДФ
Поперечный размер частиц ДФ
Для сферических частиц это диаметр сферы
d,
для кубических частиц — ребро куба L (м-1; см-1) или
дисперсность (D = 1/d, м-1, см-1).
Основные понятия. Классификация дисперсных систем
Слайд 20Формы дисперсной фазы n
Основные понятия. Классификация дисперсных
систем
Слайд 21 Количественные характеристики ДФ
Удельная поверхность
Удельная поверхность для сферической
частицы с радиусом r
Удельная поверхность для кубической
частицы с ребром куба
Удельная поверхность Syд — это межфазная поверхность, приходящаяся на единицу объема ДФ (V) или ее массы (т).
Основные понятия. Классификация дисперсных систем

Слайд 22Важным свойством ДС является наличие большой межфазной
поверхности. Характерными являются процессы, протекающие на поверхности,
а не внутри фазы.
Основные понятия. Классификация дисперсных систем

Слайд 23По степени дисперсности дисперсные системы классифицируют на:
Грубодисперсные
(d ˃ 10-5 см).
Коллоидно-дисперсные (10-7 ˂ d
˂ 10-5 см).
Молекулярно-дисперсные (истинные растворы) (d ˂ 10-7 см).
Основные понятия. Классификация дисперсных систем

Слайд 24Истинный Коллоидный
Суспензия
раствор
d ˂ 10-7 см d: 10-5 – 10-7 см d ˃ 10-5 см
Основные понятия. Классификация дисперсных систем

Слайд 25Грубодисперсные (d ˃ 10-5 см) – не
проходят через тонкие бумажные фильтры, быстро оседают,
видимы в обычный микроскоп.
Коллоидно-дисперсные (10-7 ˂ d ˂ 10-5 см) – проходят через бумажные фильтры, но задерживаются на ультрафильтрах, видимы в ультрамикроскоп. Структурной единицей является мицелла.
Молекулярно-дисперсные (истинные растворы) (d ˂ 10-7 см) – дискретными единицами в них являются молекулы или ионы. Образуются самопроизвольно.
Основные понятия. Классификация дисперсных систем

Слайд 26Классификация по агрегатному состоянию ДСр и ДФ

Слайд 27Суспензии
Основные понятия. Классификация дисперсных систем

Слайд 28Эмульсии
Основные понятия. Классификация дисперсных систем

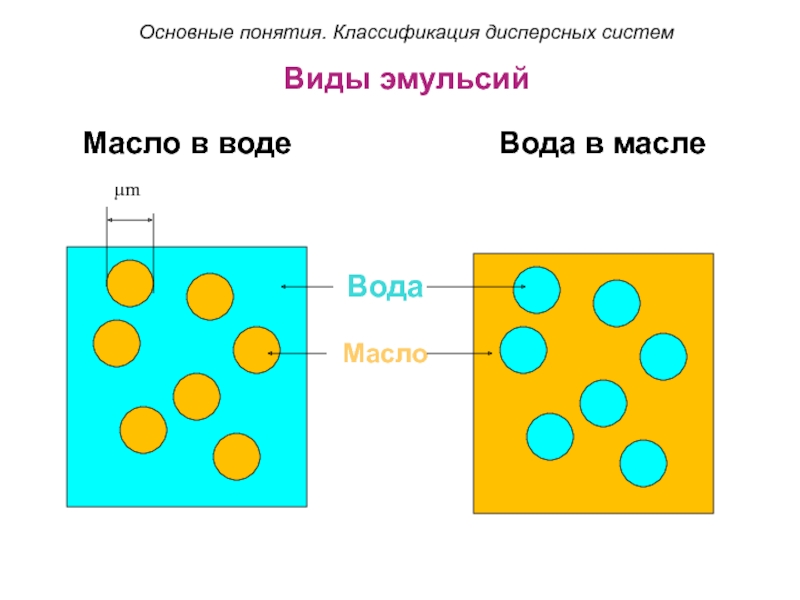
Слайд 29Виды эмульсий
Масло в воде
Вода в масле
Вода
Масло
μm
Основные понятия.
Классификация дисперсных систем
Слайд 30Диаметр частиц эмульсий
3
мм
Основные понятия. Классификация дисперсных систем
Источник: thepresentation.ru
Как получить коллоидный раствор золота
Получение золя золота
Золото в коллоидном состоянии получают восстановлением солей золота. В зависимости от степени дисперсности окраска золя меняется от голубой грубодисперс-ного золя (рис. VII-4) [8] до красной тонкодисперсного золя.
Получение голубого золя
Золотохлористоводородная кислота, 0,1%-ный раствор. Солянокислый гидразин, 0,1%-ный раствор.
Выполнение опыта. К 400 мл воды добавить 30 мл раствора золотохлористоводородной кислоты и 20 мл раствора солянокислого гидразина. Образуется прозрачный голубой золь золота.
Получение красного золя
Золотохлористоводородная кислота, 0,1%-ный раствор. Карбонат калия, 1%-ный раствор. Таннин, 1%-ный раствор.
Выполнение опыта. Поместить в стакан 400 мл воды, 10 мл раствора золотохлористоводородной кислоты и 2 мл раствора карбоната калия. По каплям при помешивании добавлять раствор таннина (желательно при нагревании). Образуется красный прозрачный золь.
Источник: himikatus.ru
Получение коллоидных растворов

Получение коллоидного раствора это процесс в результате которого образуются коллоидные частички которые и составляют этот раствор в растворителе.
Укрупнение этих частит приводит к слипанию вещества, в результате чего вещество переходит в осадок,примером служит коллоидное золото.

Что такое получение коллоидных растворов
Коллоидные растворы могут быть получены различными методами.
Некоторые вещества, обладающие сложным составом и большими молекулами, как, например, белок, желатина, гуммиарабик, образуют коллоидные растворы уже при длительном соприкосновении с водой.
Другие можно превратить в коллоидное состояние путем растирания с жидкостью. Грубые частицы можно также измельчать до коллоидных размеров в так называемых коллоидных мельницах.
Эти мельницы широко применяются на практике при изготовлении различных красок, наполнителей для бумаги и резины, в фармацевтической промышленности, в пищевой промышленности и т. д.
Раздробление веществ на коллоидных мельницах может быть доведено до частиц с диаметром, равным всего только 0,01
Проверь хорошо ли Вы знаете науки
Ты получил <> снаружи >
Указанные методы основаны на превращении крупных частиц в более мелкие и потому получили название дисперсионных методов.
Но можно идти и противоположным путем, создавая условия, при которых простые молекулы соединяются в более крупные агрегаты, не переходящие, однако, известного предела.
Конденсационные методы получения коллоидных растворов
В основе их лежат химические реакции, протекающие в водных растворах.
Соответственно регулируя условия реакций, во многих случаях, можно добиться, чтобы образующееся при реакции нерастворимое вещество выделялось в виде коллоидных частиц того или иного размера, и таким образом получить коллоидный раствор.
Так, например, описанный выше коллоидный раствор золота легко получить восстановлением хлорного золота формалином.
Способы получения коллоидный растворов

Нальем в пробирку дистиллированной воды и прибавим к ней несколько капель 1%-ного раствора АuСl3.
Нагрев раствор до кипения, вольем в него 2—3 мл очень слабого раствора формалина.
Жидкость приобретает красивый пурпурный цвет вследствие выделения коллоидных частиц золота:
Конечно, золото выделяется в этом случае сначала в виде отдельных атомов, которые, однако, сейчас же связываются в более крупные агрегаты.
Примеры образования коллоидных растворов
Приведем еще примеры образования коллоидных растворов при химических реакциях.
1. Нагреем в стакане до кипения некоторое количество де-стиллированной воды и будем прибавлять к ней по каплям раствор хлорного железа FeCl3.
Вследствие гидролиза большая часть хлорного железа превращается в гидрат окиси железа:
Одновременно получается некоторое количество основной соли FeOCl.
Хотя гидрат окиси железа нерастворим в воде, но при этих условиях он не выпадает в осадок, а остается в растворе в виде мельчайших частиц.
Получается прозрачный золь Fe(OH)3, имеющий окраску крепкого чая.
2. В раствор мышьяковистой кислоты будем пропускать некоторое время сероводород:
Получается прозрачный золотисто-желтый золь сульфида мышьяка.
3. К конденсационным методам должен быть отнесен и метод получения металлов при помощи электрической дуги.
Изучение этого явления показало, что при проскакивании искры металл непосредственно превращается в пар, состоящий из отдельных атомов; образование же коллоидных частиц металла происходит уже в результате конденсации пара.
Дисперсные системы
Дисперсные системы – гетерогенные системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом (дисперсионная среда).
Свойства вещества в раздробленном (дисперсном) состоянии значительно отличаются от свойств того же вещества, находящегося в виде твердого тела или некоторого объема жидкости.
Существует несколько различных классификаций дисперсных частиц: по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды,.
По характеру взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды, по термодинамической и кинетической устойчивости.
Как устроена мицелла

Коллоидная частица представляет собой ядро из малорастворимого вещества коллоидной дисперсности, на поверхности которого адсорбируются ионы электролита раствора.
Ионы электролита обеспечивают устойчивость золя, поэтому данный электролит называют ионным стабилизатором. Значит, коллоидная частица представляет собой комплекс, состоящий из ядра, вместе с адсорбционным слоем противоионов.
Рис. 2. Структура мицеллы As2S3
Агрегат частицы или ядро представляет собой вещество кристаллического строения, состоящий из сотен или тысячи атомов, ионов или молекул, окружённый ионами. Ядро вместе с адсорбированными ионами называется гранулой.
Так гранула имеет определённый заряд. Вокруг неё собираются противоположно заряженные ионы, придающие ей в целом электронейтральность. Вся система, состоящая из гранулы и окружающих её ионов называется мицеллой и является электронейтральной.
Свойства коллоидных систем
Это свойство рассеивание света (опалесценция) (указывает на неоднородность, многофазность системы).
Опалесценция становится особенно заметной, если, как это делал Тиндаль (через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу.
При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).
Как разрушить коллоидные растворы
Процесс укрупнения коллоидных частиц, приводящий к уменьшению степени дисперсности диспергированного вещества, называется коагуляцией.
Примером может служить реакция восстановления золота из его раствора, сначала образуется коллоидный раствор золота, а затем раствор укрупняется и выпадает в осадок.
Коагуляция, или слипание частиц, приводит к осаждению (седиментации) крупных агрегатов в виде осадка.
Что вызывает коагуляцию
Снижение устойчивости коллоидных систем вызывают введением электролитов, которые изменяют структуру диффузного слоя ионов.
Причем коагулирующим действием в электролите обладают только те ионы, (коагуляторы), которые несут заряд, по закону одноименной с зарядом противоиона коллоидной частицы.
Коагулирующее действие иона коагулятора тем больше, чем больше его заряд.
Коагуляция – самопроизвольный процесс, возникающий из-за стремления системы перейти в состояние с более низкой поверхностной энергией и более низким значением изобарного потенциала.
Процесс седиментации скоагулированного вещества также протекает самопроизвольно. Коагуляция может быть обусловлена различными причинами, наиболее эффективно действие электролитов.
Минимальная концентрация электролита в растворе, вызывающая коагуляцию, называется порогом коагуляции. Коагуляция также возникает при смещении двух золей с различными знаками зарядов частиц. Это явление называется взаимной коагуляцией.
Кто открыл коллоидные растворы
Обычно считают, что основателем коллоидной химии является английский ученый Томас Грэм(1805-1869), который в 50-60-е годы позапрошлого столетия ввел в обращение основные коллоидно-химические понятия.
Однако не следует забывать, что у него имелись предшественники, и прежде всего – Яков Берцелиус, итальянский химик Франческо Сельми. В 30-е годы XIX века Берцелиус описал ряд осадков, проходящих при промывании через фильтр (кремниевая и ванадиевая кислоты, хлористое серебро, берлинская лазурь и др.).
Эти проходящие через фильтр осадки Берцелиус назвал «растворами», но в то же время он указал на их близкое сродство с эмульсиями и суспензиями, со свойствами которых он был хорошо знаком.
Франческо Сельми в 50-е годы XIX века продолжил работы в этом направлении, ища физико-химические различия между системами, образованными осадками, проходящими через фильтр (он назвал их «псевдорастворами») и обычными истинными растворами.
Майкл Фарадей
Английский ученый Майкл Фарадей в 1857 г. синтезировал коллоидные растворы золота – взвесь Au в воде размерами частиц от 1 до 10 нм. и разработал методы их стабилизации.
Эти «псевдорастворы» рассеивают свет, растворенные в них вещества выпадают в осадок при добавлении небольших количеств солей, переход вещества в раствор и осаждение из него не сопровождаются изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ.
Томас Грэм
Томас Грэм развил эти представления о различии между «псевдорастворами» и истинными растворами и ввел понятие «коллоид».
Грэм обнаружил, что вещества, способные к образованию студнеобразных аморфных осадков, такие как гидроокись алюминия, альбумин, желатина, диффундируют в воде с малой скоростью по сравнению с кристаллическими веществами (NaCl, сахароза).
В то же время кристаллические вещества легко проходят в растворе через пергаментные оболочки («диализируют»), а студнеобразные вещества не проходят через эти оболочки.
Принимая клей за типичный представитель студнеобразных не диффундирующих и не диализирующих веществ, Грэм дал им общее название «коллоид», т.е. клееобразный (от греческого слова колла – клей).
Кристаллические вещества и вещества, хороши диффундирующие и диализирующие он назвал «кристаллоидами».
Статья на тему Получение коллоидных растворов
Похожие страницы:
Устойчивость коллоидных растворов Как и молекулы истинных растворов, коллоидные частицы золей находятся в состоянии непрерывного беспорядочного движения (броуновское движение). Хотя.
Состав коллоидных частиц Коллоидные растворы отличаются от истинных растворов значительно большими размерами дисперсных частиц. В истинных растворах дисперсными частицами являются.
Пересыщенные растворы Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обыкновенно выделяется.
Электропроводность растворов Хорошими проводниками электрического тока, помимо металлов, являются расплавленные соли и основания. Способностью проводить ток обладают также водные растворы.
Что такое коагуляция Это — процесс укрупнения коллоидных частиц носит название коагуляции или свертывания. Очень медленно он происходит во всяком.
Дисперсные системы Если разболтать в воде мелкий порошок какого-нибудь нерастворимого вещества, например глины, то более крупные частицы вскоре оседают на.
Понравилась статья поделись ей
Источник: znaesh-kak.com