Реакция термического разложения оксида золота (III)
Поделитесь информацией:
Уравнение реакции термического разложения оксида золота (III):
Реакция термического разложения оксида золота (III).
В результате реакции образуются золото и кислород.
Реакция протекает при условии: при температуре 160-290 °C.
Формула поиска по сайту: 2Au2O3 → 4Au + 3O2.
Коэффициент востребованности 402
- ← Реакция термического разложения хлорида золота (I)
- Реакция взаимодействия оксида магния и углерода →
Вам также может понравиться
Реакция взаимодействия оксида серы (VI) и сероводорода
Реакция разложения оксида азота (V)
Реакция взаимодействия оксида германия (IV) и оксида лития
Разделы
- Определения
- Соли
- Списки химических реакций
- Списки химических реакций сложных веществ
- Справочники
- Статьи на общие темы
- Химические вещества
- Химические реакции
- Химические элементы
ТОП 5 записей
- Таблица оксидов
- Таблица молярных масс химических элементов
- Таблица электроотрицательности химических элементов
- Таблица валентности химических элементов
- Таблица кислот и кислотных остатков
Популярные записи
- Таблица оксидов
- Таблица молярных масс химических элементов
- Таблица электроотрицательности химических элементов
- Таблица валентности химических элементов
- Таблица кислот и кислотных остатков
- Таблица молярной теплоемкости химических элементов
- Количество протонов, нейтронов и электронов химических элементов
- Таблица электронных формул атомов химических элементов
- Таблица и формулы оснований
- Таблица степеней окисления химических элементов
Элементы, реакции, вещества
- Химические элементы
- Химические реакции
- Химические вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
ЖЕЛЕЗНЫЙ СУРИК. Как получить оксид железа 3? Железо 3 оксид [Fe2O3] — Iron 3 oxide.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Определения
Наши сайты и проекты
ты и проекты
18+
На сайте показывается реклама.
Структура, свойства, номенклатура и применения оксида золота (III) (Au2O3)
оксид золота (III) неорганическое соединение, химическая формула которого Au2О3. Теоретически можно ожидать, что его природа будет ковалентного типа. Однако наличие определенного ионного характера в его твердом теле не может быть полностью исключено; или что то же самое, предположим, что отсутствие катиона 3+ рядом с анионом O 2- .
Может показаться противоречивым, что золото, будучи благородным металлом, может ржаветь. При нормальных условиях кусочки золота (как звезды на изображении ниже) не могут окисляться при контакте с кислородом в атмосфере; однако при облучении ультрафиолетовым излучением в присутствии озона ИЛИ3, картина отличается.
ЧИСТКА ЗОЛОТА 3 гр, ПОСЛЕ АФФИНАЖА ЧИПОВ! ПРОСТО И ДОСТУПНО!

Если бы золотые звезды подвергались этим условиям, они бы стали красновато-коричневыми, характерными для Au.2О3.
Другие способы получения этого оксида будут включать химическую обработку указанных звезд; например, преобразование массы золота в соответствующий хлорид, AuCl3.
После, к AuCl3, и остальная часть возможных образованных солей золота добавляют сильную основную среду; и с этим, вы получите гидратированный оксид или гидроксид, Au (OH)3. Наконец, это последнее соединение термически дегидратируется для получения Au.2О3.
- 1 Структура оксида золота (III)
- 1.1 Электронные аспекты
- 1.2 Гидраты
- 2.1 Внешний вид
- 2.2 Молекулярная масса
- 2.3 Плотность
- 2.4 Точка плавления
- 2.5 Стабильность
- 2.6 Растворимость
- 4.1 Окраска очков
- 4.2 Синтез ауратов и молниеносного золота
- 4.3 Обработка самосборных монослоев
Структура оксида золота (III)
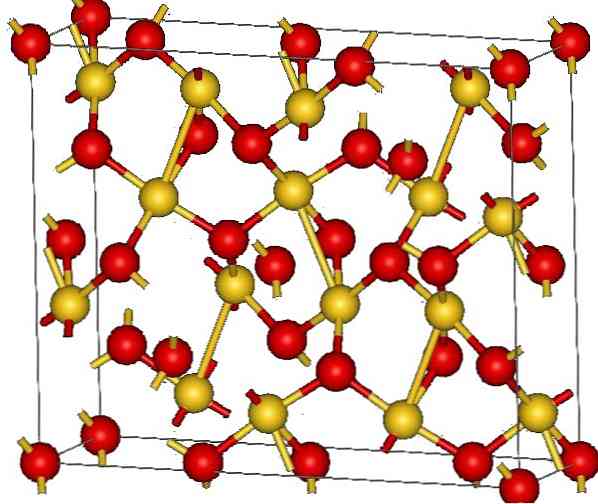
Кристаллическая структура оксида золота (III) показана на верхнем изображении. Расположение атомов золота и кислорода в твердом теле показано либо в виде нейтральных атомов (ковалентное твердое вещество), либо в виде ионов (ионное твердое тело). Нечетко, достаточно в любом случае устранить или разместить ссылки Au-O.
Согласно изображению предполагается, что преобладает ковалентный характер (что было бы логично). По этой причине представленные атомы и связи показаны со сферами и столбцами, соответственно. Золотые сферы соответствуют атомам золота (Au III -О) и красноватые до атомов кислорода.
Если вы посмотрите внимательно, вы увидите, что есть единицы AuO4, которые соединены атомами кислорода. Другим способом визуализации было бы учесть, что каждый Au 3+ окружен четырьмя O 2- ; Конечно, с ионной точки зрения.
Эта структура является кристаллической, потому что атомы упорядочены, следуя той же схеме дальнего действия. Таким образом, его унитарная ячейка соответствует ромбоэдрической кристаллической системе (так же, как на верхнем изображении). Поэтому все Au2О3 может быть построен, если бы все эти сферы элементарной ячейки были распределены в пространстве.
Электронные аспекты
Золото является переходным металлом, и следует ожидать, что его 5d-орбитали взаимодействуют непосредственно с 2p-орбиталями атома кислорода. Это перекрытие их орбиталей теоретически должно генерировать зоны проводимости, которые бы преобразовывали Au2О3 в твердом полупроводнике.
Таким образом, истинная структура Au2О3 еще сложнее с этим в виду.
гидраты
Оксид золота может удерживать молекулы воды в своих ромбоэдрических кристаллах, что приводит к образованию гидратов. Когда образуются такие гидраты, структура становится аморфной, то есть неупорядоченной.
Химическая формула для таких гидратов может быть любой из следующих, которые на самом деле не уточнены: Au2О3∙ ж2O (z = 1, 2, 3 и т. Д.), Au (OH)3, или AuхОи(ОН)Z.
Формула Au (OH)3 представляет чрезмерное упрощение истинного состава указанных гидратов. Это связано с тем, что в гидроксиде золота (III) исследователи также обнаружили присутствие Au2О3; и поэтому имеет смысл рассматривать его изолированно как «простой» гидроксид переходного металла.
С другой стороны, твердого тела с формулой AuхОи(ОН)Z можно ожидать аморфную структуру; так как это зависит от коэффициентов х, и и Z, чьи вариации породили бы все виды структур, которые едва ли могли бы иметь кристаллическую структуру.
свойства
Внешний вид
Это красновато-коричневое твердое вещество.
Молекулярная масса
плотность
Точка плавления
Тает и разлагается при 160ºC. Поэтому ему не хватает температуры кипения, поэтому этот оксид никогда не достигает температуры кипения.
стабильность
Au2О3 оно термодинамически нестабильно, потому что, как упоминалось в начале, золото не склонно окисляться при нормальных температурных условиях. Так что его легко уменьшить, чтобы снова стать благородным золотом.
Чем выше температура, тем быстрее протекает реакция, известная как термическое разложение. Итак, Au2О3 при 160 ° C он разлагается, образуя металлическое золото и выделяя молекулярный кислород:
Очень похожая реакция может происходить с другими соединениями, которые способствуют указанному восстановлению. Почему сокращение? Потому что золото возвращается, чтобы получить электроны, которые кислород забрал у него; это то же самое, что сказать, что он теряет связь с кислородом.
растворимость
Это твердое вещество, нерастворимое в воде. Однако он растворим в соляной кислоте и азотной кислоте из-за образования хлоридов и нитратов золота.
номенклатура
Оксид золота (III) — это название, определяемое номенклатурой запасов. Другие способы упомянуть это:
-Традиционная номенклатура: оксид аурика, потому что валентность 3+ является самой высокой для золота.
-Систематическая номенклатура: диоксид триоксида.
приложений
Окраска очков
Одним из наиболее выдающихся применений является придание красноватых цветов некоторым материалам, таким как стекла, в дополнение к приданию определенных свойств, присущих атомам золота..
Синтез ауратов и молниеносного золота
Если Au добавлен2О3 в среду, где он растворим, и в присутствии металлов аураты могут выпадать в осадок после добавления сильного основания; которые образованы анионами AuO4 — в компании металлических катионов.
Кроме того, Au2О3 реагирует с аммиаком с образованием молниеносного соединения золота, Au2О3(NH3)4. Его название происходит от того факта, что он очень взрывоопасен.
Обработка самосборных монослоев
Что касается золота и его оксида, некоторые соединения, такие как диалкилдисульфиды, RSSR, не адсорбируются одинаково. Когда происходит эта адсорбция, спонтанно образуется связь Au-S, где атом серы проявляет и определяет химические характеристики указанной поверхности в зависимости от функциональной группы, с которой она связана..
RSSR не может адсорбироваться на Au2О3, но на металлическом золоте. Поэтому, если поверхность золота и его степень окисления модифицируются, а также размер частиц или слоев Au2О3, может быть разработана более неоднородная поверхность.
Это поверхность ау2О3-AuSR взаимодействует с оксидами металлов некоторых электронных устройств, тем самым создавая в будущем более умные поверхности.
ссылки
- Wikipedia. (2018). Золото (III) оксид. Получено с: en.wikipedia.org
- Химическая формула (2018). Оксид золота (III). Извлечено из: формулаcionquimica.com
- Д. Мишо. (24 октября 2016 г.) Оксиды золота. 911 Металлург. Получено с: 911metallurgist.com
- Ши, Р. Асахи и С. Штампфл. (2007). Свойства оксидов золота Au2О3 и Au2O: Расследование по первым принципам. Американское физическое общество.
- Кук, Кевин М. (2013). Оксид золота как маскирующий слой для региоселективной химии поверхности. Диссертации и диссертации. Бумага 1460.
Источник: ru.thpanorama.com
Большая Энциклопедия Нефти и Газа
Оксиды золота и серебра легко разлагаются при нагревании. Оксиду меди ( П) соответствует гидроксид Си ( ОН) 2, оксиду золота ( Ш) — дигидрат А Оз 2Н2О, который проявляет амфотерные свойства с преобладанием кислотных. [1]
Оксид золота ( III) Au2O3 ( коричневый) может быть получен при осторожном нагреваний гидроксида Аи ( ОН) 3 до 150 С. [2]
Оксиды золота и серебра легко разлагаются при нагревании. [3]
Оксид золота ( III) Au2O3 — порошок темно-коричневого цвета; теплота его образования — 46 0 кдж / моль; термически неустойчив и разлагается при нагревании около 160 С. [4]
Пю гидрат оксида золота ( Ш) ( тв, см. Пд) гидроксид-ион ( п / к) — раствор. [5]
В концентрированных щелочах оксид золота несколько лучше растворяется, чем в кислотах, следовательно, обладает амфотерным характером с более выраженными кислотными функциями. [6]
Производные одновалентного золота — это оксид золота ( I) Au2O, галиды AuHlg, сульфид Au2S, а также комплексные соединения. Все эти соединения, кроме комплексных, крайне плохо растворимы. [7]
Напишите формулы: а) двух оксидов золота , в одном из которых золото одновалентно, а в другом — трехвалентно, б) оксида кадмия ( II), в) двух оксидов хрома, в одном из которых хром трехвалентен, а в другом — шести валентен. [8]
Однако уже при температуре около 160 С оксид золота ( III) разлагается на элементы. Гидроксид золота ( III) проявляет амфотерные свойства. Однако кислотный характер этого соединения преобладает, поэтому иногда его называют золотой кислотой. [9]
Озон химически активен, окисляет даже золото до оксида золота ( I), серебро до пероксида серебра ( I), иодид ионы в растворе KI, непредельные углеводороды. [10]
В течение всего времени опыта ( 4 — 6 нед) в нижней части ампулы при 290 — 260 С растворяется гидрат оксида золота , а в верхней трети ампулы при 250 — 220 С происходит кристаллизация препарата на стенках. Кристаллы в падающем свете коричневые, в проходящем — рубиново-красные. Они достигают размеров 0 5X0 4X0 4 мм и имеют хорошо построенные плоскости. Для удаления КС1О4 кристаллы Аи2О промывают горячей водой. Следует соблюдать осторожность: ампула по окончании опыта находится под давлением. [11]
Окраска многих минералов и драгоценных камней обусловлена наличием в них высокодисперсных частиц металлов и их оксидов. Например, прозрачным рубиновым стеклам окраску придают коллоидные частицы оксидов золота , железа. [12]
Окраска многих минералов и драгоценных камней обусловлена наличием в них высокодисперсных частиц металлов и их оксидов. Например, прозрачные рубиновые стекла обязаны своей окраской наличию коллоидных частиц оксидов золота , железа. [13]
Оксиды золота и серебра легко разлагаются при нагревании. Оксиду меди ( П) соответствует гидроксид Си ( ОН) 2, оксиду золота ( Ш) — дигидрат А Оз 2Н2О, который проявляет амфотерные свойства с преобладанием кислотных. [14]
Для построения своей схемы он выбрал систему, содержавшую наиболее важные, по его мнению, металлы или их соединения, которые он разбил на шесть групп: первая группа — калий, натрий, аммоний; вторая группа — барит, стронцианит, известь, магнезия; третья группа — глинозем и оксид хрома; четвертая группа — оксиды цинка, марганца, никеля, кобальта и железа; пятая группа — оксиды серебра, ртути, свинца, висмута, меди, кадмия; шестая группа — оксиды золота , платины, сурьмы, олова, мышьяковая и мышьяковистая кислоты. [15]
Источник: www.ngpedia.ru