Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p + | +1 | 1 |
| Нейтрон n 0 | 1 | |
| Электрон e — | -1 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Что нужно знать о золоте — элемент 79
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35 Cl и 37 Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35 Cl | 17 | 18 | 17 |
| 37 Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.

Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии:в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Как открыть металлический счёт и покупать на него золото и другие металлы
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули:на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда:суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона.
При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий. Рассмотрим p-подуровень. На нём имеются 3 орбитали (см. таблицу выше). В целом, есть разные варианты развития событий. Допустим, у нас есть 4 электрона, которые надо расположить на подуровне.
Мы можем поместить два в первую ячейку, два во вторую. Посчитаем суммарный спин. У двух элетронов спин 1/2, у других -1/2. Тогда при сложении мы получаем ноль. Теперь расположим три первых электрона по одному, оставшийся поместим на первую орбитал (в пару).
Теперь суммарный спин 1. Значит, подходит второй случай. Для того чтобы каждый раз не высчитывать суммарный спин, можно запомнить, что вначале следует расположить все имеющиеся электроны по одному, и если на подуровне уже не останется свободных ячеек, начинать составлять пары.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s 2 2s 2 2p 6 .Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s 2 . Итого получаем1s 2 2s 2 2p 6 3s 2 .

В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).

— фосфор – пятнадцатый элемент, находится в главной подгруппе. Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s 2 2s 2 2p 6 .Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s 2 3p 3 . Итого получаем1s 2 2s 2 2p 6 3s 2 3p 3 .

В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).

— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .

В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.

Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s 2 3d 4 и 4s 2 3d 9 имеют вид 4s 1 3d 5 и 4s 1 3d 10 .


Задания для тренировки :
- Сколько протонов и электронов содержит ион NO2 —
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2 Н
2) 40 Аr
3) 41 Ar
4) 39 К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Спасибо за то, что пользуйтесь нашими материалами. Информация на странице «Строение атома» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам. Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий. Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена: 06.06.2023
Источник: ege-study.ru
Золото
Брелок 20х30 мм. Золото. Артикул: pt79
Брелок 20х40 мм. Золото (Au) Артикул: 79477
нет в наличии
Золото (Au), 99,9%, фольга – в стеклянной баночке. Артикул: 7982130518

Игральная кость классическая 10 мм. Au Артикул: dc13
нет в наличии

Игральная кость октаэдр (8 граней). Au Артикул: dc8
нет в наличии
нет в наличии

Кулон. Золото. Артикул: 7988120320

Пуговица 18 мм. Золото. Артикул: but79
нет в наличии

Атомный номер 79
Атомная масса 196,97
Плотность, кг/м? 19300
Температура
плавления, °С 1063
Золото — мягкий металл жёлтого цвета. Золото было первым металлом, известным человеку. Изделия из Золота найдены в культурных слоях эпохи неолита (5-4-е тысячелетия до н. э.). В древних государствах — Египте, Месопотамии, Индии, Китае.
Добыча Золота, изготовление украшений и других предметов из него существовали за 3-2 тысячелетия до н. э. Золото часто упоминается в Библии, «Илиаде», «Одиссее» и других памятниках древней литературы. Алхимики называют Золото «царем металлов» и обозначали его символом Солнца; открытие способов превращения неблагородных металлов в Золото было главной целью алхимии.
- Пазлы (54)
- Наборы (33)
- Брелоки (130)
- Акриловые кубики / Acrylic cubes (95)
- Кулоны/ Pendants (107)
- Газы/ Gases (55)
- Металлические кубики 10 мм х 10 мм/ metal cubes 10 mm x 10 mm (57)
- Другое (5)
- Азот (7)
- Актиний (1)
- Алюминий (23)
- Америций (1)
- Аргон (6)
- Астат (1)
- Барий (5)
- Бериллий (8)
- Берклий (1)
- Бор (8)
- Борий (0)
- Бром (7)
- Ванадий (11)
- Висмут (20)
- Водород (14)
- Вольфрам (15)
- Гадолиний (8)
- Галлий (8)
- Гафний (10)
- Гелий (7)
- Германий (11)
- Гольмий (8)
- Дармштадтий (0)
- Диспрозий (7)
- Дубний (0)
- Европий (7)
- Железо (12)
- Золото (14)
- Индий (9)
- Иод (6)
- Иридий (8)
- Иттербий (8)
- Иттрий (10)
- Кадмий (9)
- Калий (10)
- Калифорний (1)
- Кальций (4)
- Кислород (4)
- Кобальт (11)
- Коперниций (0)
- Кремний (14)
- Криптон (6)
- Ксенон (8)
- Кюрий (1)
- Лантан (7)
- Ливерморий (0)
- Литий (6)
- Лоуренсий (1)
- Лютеций (8)
- Магний (9)
- Марганец (8)
- Медь (23)
- Мейтнерий (0)
- Менделевий (1)
- Молибден (15)
- Мышьяк (5)
- Натрий (9)
- Неодим (7)
- Неон (7)
- Нептуний (1)
- Никель (11)
- Ниобий (22)
- Нихоний (Унунтрий) (0)
- Нобелий (1)
- Олово (9)
- Осмий (7)
- Палладий (11)
- Платина (12)
- Плутоний (1)
- Полоний (1)
- Празеодим (7)
- Прометий (0)
- Протактиний (1)
- Радий (1)
- Радон (1)
- Резерфордий (0)
- Рений (10)
- Рентгений (0)
- Родий (7)
- Ртуть (8)
- Рубидий (16)
- Рутений (8)
- Самарий (8)
- Свинец (9)
- Селен (10)
- Сера (11)
- Серебро (19)
- Сиборгий (0)
- Скандий (8)
- Стронций (4)
- Сурьма (9)
- Таллий (0)
- Тантал (17)
- Теллур (8)
- Тербий (7)
- Технеций (0)
- Титан (13)
- Торий (1)
- Тулий (8)
- Углерод (16)
- Унуноктий (Оганесон) (0)
- Унунпентий (Московий) (0)
- Унунсептий (Теннессин) (0)
- Уран (1)
- Фермий (1)
- Флеровий (0)
- Фосфор (7)
- Франций (1)
- Фтор (5)
- Хассий (0)
- Хлор (9)
- Хром (10)
- Цезий (15)
- Церий (7)
- Цинк (16)
- Цирконий (13)
- Эйнштейний (1)
- Эрбий (8)
- Пуговицы / Buttons (52)
- Браслеты / bracelet (29)
- Акриловые кубики (0)
- Кулоны (0)
- О магазине
- Оплата и доставка
- Об элементах
- Политика безопасности
- Связаться с нами
- Возврат товара
- Карта сайта
Источник: chemical-elements.ru
Особенности строения электронных оболочек атомов элементов
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.

Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атома
Представим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.
- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
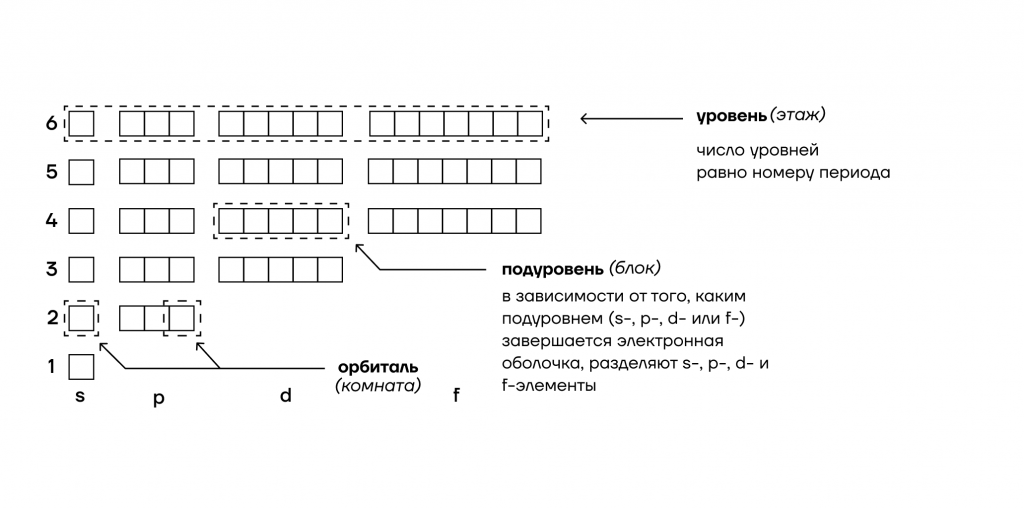
1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4.
2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей).
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электроновв атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгруппколичество электронов на внешнем энергетическом уровне равно двум. Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
- Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.

Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атома
Для изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.

Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
| Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов.
Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.

Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.

К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли?
Однако, да, химические элементы разделяют на семейства по строению их электронных оболочек. Таких семейств выделяют четыре:
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Проверь себя
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.
Источник: umschool.net