Состав молекул приводится в виде химических формул. Химическая формула показывает, какие элементы и в каком количестве входят в состав данной молекулы (химического соединения). Следует различать простейшую и истинную формулу вещества. Простейшая формула показывает наименьшие целочисленные количества элементов в молекуле. Состав молекулы определяется валентностями элементов в данной молекуле. Например, формулы гидридов для элементов второго периода имеют следующий состав:
Строение молекул определяется строением атомов, входящих в состав данной молекулы, и геометрией орбиталей, образовавших химические связи. Строение молекул воды, аммиака и метана приведено далее на рисунке 16.1.
Если атом образует несколько связей с участием различных орбиталей, то может происходить такое явление, как гибридизация атомных орбиталей.
Гибридизация – это выравнивание формы и энергии различных орбиталей при образовании ковалентной связи.
Разберем данный вопрос на примере гибридизации орбиталей атома углерода в молекуле метана (СН4). На рисунке 14.1 приведены четыре орбитали атома углерода и показаны формы четырех гибридных орбиталей. Так как в гибридизации участвуют одна s- и три p-орбитали, возникают четыре sp 3 -гибридные орбитали.
Типы кристаллических решеток
s-, px-, py-, pz- орбитали атома углерода четыре sp 3 -гибридные орбитали
Рисунок 14.1 – sp 3 -гибридизация валентных орбиталей углерода
Четыре гибридные орбитали углерода располагаются симметрично относительно друг от друга. В результате этого молекула метана имеет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28′.
Кристаллическая структура вещества характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В зависимости от того, какой тип взаимодействия осуществляется между частицами, занимающими узлы в кристаллической решетке, различают четыре типа кристаллических решеток: атомная, ионная, металлическая и молекулярная.
Атомная кристаллическая решётка – построена из атомов, соединенных между собой прочными ковалентными связями. Данные кристаллы обладают высокой температурой плавления и низкой тепло- и электропроводностью. Являются крайне твердыми, но хрупкими веществами. Например, алмаз.
Ионная кристаллическая решётка состоит из положительных и отрицательных ионов, между которыми действуют электростатические силы. Температуры плавления ионных кристаллов выше, чем атомных и молекулярных. Такие кристаллы образуются между элементами с сильно различающимися электроотрицательностями. Например, NaCl.
Металлическая кристаллическая решетка – содержитв узлах кристаллической решётки ионы металла и свободные электроны, принадлежащие всему кристаллу металла. Взаимодействие между ионами металла и свободными электронами обеспечивает прочную металлическую связь. Свободные электроны могут свободно перемещаться в объёме кристалла, поэтому их иногда называют «электронным газом». Наличие электронов, свободно перемещающихся по всему кристаллу металла, объясняет такие характерные для металлов свойства, как высокие электро- и теплопроводность, пластичность.
Типы кристаллических решеток. 8 класс.
Молекулярная кристаллическая решетка образуется между неполярными или слабополярными молекулами. Поскольку силы взаимодействия между молекулами в этих решетках являются слабыми, такие вещества плавятся при низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы. Например, СН4, СО2 и др. Энергия межмолекулярного взаимодействия меньше водородной связи и составляет примерно 2÷20 кДж/моль.
В 1873 г. голландский ученый Ван-дер-Ваальс объяснил природу сил, обуславливающих притяжение между отдельными молекулами.
Межмолекулярные взаимодействия делятся на:
– ориентационные – возникают между полярными молекулами.
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 15.1).
| Рисунок 15.1– Ориентационное взаимодействие |
– индукционные – возникают между полярными и неполярными молекулами. Полярные молекулы индуцируют на неполярных диполи, которые затем электростатически взаимодействуют друг с другом (рисунок 15.2).
Часть вторая. ХИМИЯ ЭЛЕМЕНТОВ
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Какой тип кристаллической решетки у золота ионная
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §10 Строение кристаллов. Кристаллические решётки РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение , а фиолетовым ― объяснение.
Задание 2
Какова природа химической связи между частицами в ионных, атомных, металлических и молекулярных кристаллах?
В ионных кристаллах действуют силы электростатического притяжения, в атомных ― ковалентные связи, в металлических – силы электростатического притяжения, в молекулярных ― силы межмолекулярного взаимодействия, которые могут иметь различную природу.
Задание 3
Какой тип кристаллической решётки характерен:
а) для льда; Молекулярная
б) для хлорида натрия; Ионная
в) для иода; Молекулярная
г) для железа; Металлическая
д) для алмаза? Атомная
Задание 4
На конкретных примерах сравните физические свойства веществ, существующих в виде металлических и ионных кристаллов.
Хлорид натрия ― вещество с ионной кристаллической решёткой ― твёрдое и тугоплавкое за счёт сил электростатического притяжения между ионами, которые крайне неохотно меняют своё местоположение под влиянием внешнего усилия или повышения температуры, поэтому является хрупким. Кристаллический NaCl не проводит электрический ток, потому что в пространстве между ионами нет свободных электронов.
Металлический натрий (s-элемент) ― вещество с металлической кристаллической решёткой ― имеет мало обобществлённых электронов, поэтому его кристаллы непрочные и легкоплавкие.
Железо (d-элемент) ― вещество с металлической кристаллической решёткой ― прочный металл, отдельные слои атомов в кристалле металла могут относительно легко скользить один по другому, поэтому пластичный и ковкий. П роводит электрический ток, т.к. имеет свободные электроны .
Задание 5
В какой массе воды нужно растворить 27,8 г кристаллогидрата сульфата железа (II) FeSO4•7H2O, чтобы получить 3,8%-ный раствор сульфата железа (II) FeSO4?
Дано: m(FeSO4•7H2O)=27,8 г, ω(FeSO4)=3,8%
Найти: m(H2O)-?
Решение
1. Количество вещества кристаллогидрата рассчитываем по формуле: n=m/M, где M ― молярная масса
M(FeSO4•7H2O)=M(FeSO4)+7•M(H2O)=152+7•18=278 г/моль
n(FeSO4•7H2O)=m(FeSO4•7H2O)/M(FeSO4•7H2O)=27,8 г : 278 г/моль=0,1 моль
2. Находим количество вещества соли FeSO4 , содержащейся в 0,1 моль кристаллогидрата .
В 1 моль кристаллогидрата FeSO4•7H2O содержится 1 моль соли FeSO4 , количество вещества одинаковое, поэтому n(FeSO4)=n(FeSO4•7H2O)=0,1 моль
3. Массу соли FeSO4 рассчитываем по формуле: m=n•M
M(FeSO4)=152 г/моль
m(FeSO4)=n(FeSO4) • M(FeSO4)=0,1 • 152=15,2 г
4. Вычисляем массу раствора.
m(раствора)=(m(FeSO4):ω(FeSO4)) •100% =(15,2 г : 3,8%) •100% =400 г
5. Вычисляем массу воды в растворе.
m(H2O)=m(раствора)−m(FeSO4 • 7H2O)=400 г − 27,8 г=372,2 г
Ответ: m(H2O)=372,2 г
- Рудзитис Химия 11 класc 2019
- 2021-09-23
Источник: gdz.cool
6. Теоретические основы в химии Читать 0 мин.
Большинство веществ, в зависимости от условий (темература, давление) могут находится в трех агрегатных состояниях. Все твердые вещества можно разделить на аморфные и кристаллические.
КРИСТАЛЛИЧЕСКОЕ ВЕЩЕСТВО: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
АМОРФНОЕ ВЕЩЕСТВО: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.

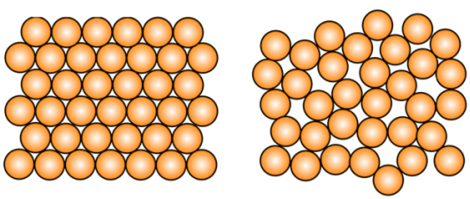
Сейчас мы будем рассматривать только кристаллические вещества.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
Тип кристаллической решетки
Частицы в узлах решетки
Не прочный, Низкая Тпл, Летучие
Благородные газы: Ne, Ar …
Галогены: F 2 , Cl 2
Галогеноводороды: HF, HCl …
Простые вещества неметаллы:
О 2 , Н 2 , N 2 , P(белый)
Оксиды и водородные соединения неметаллов: SO 2 , CO 2 , NH 3 , PH 3
Ковалентная (полярная и неполярная)
Расплавы и растворы проводят эл.ток
Соли, оксиды и гидроксиды металлов
Электро- и теплопроводные
Металлы и сплавы
Очень высокие Тпл
SiO 2 (кремнезем, кварц)
CaC 2 , SiC (карборунд),
BN, Fe 3 C, P черный и красные
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл..
Источник: reshutest.ru