Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
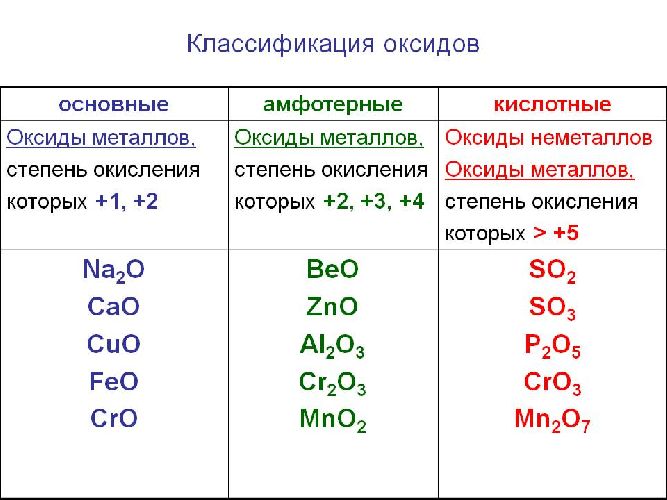
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция Оксидов
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов

Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Источник: chemege.ru
Основные оксиды, перечень, список, физические и химические свойства

Основные оксиды, перечень, список, физические и химические свойства.
Поделиться в:




Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
Основные оксиды:
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
В свою очередь оксидами называют неорганические химические соединения, состоящие из двух химических элементов, одним из которых является кислород. Кислород в оксидах проявляет степень окисления -2. Все оксиды делятся на солеобразующие и несолеобразующие.
К солеобразующим оксидам помимо основных оксидов также относят кислотные и амфмотерные оксиды. Соответственно кислотным оксидам соответствуют кислоты, амфотерным оксидам – амфотерные основания.
К основным оксидам относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Какие оксиды основные? Список, примеры и перечень основных оксидов:
| Название оксида: | Химическая формула: |
| Оксид бария | BaO |
| Оксид калия | K2O |
| Оксид кальция | CaO |
| Оксид лития | Li2 O |
| Оксид магния | MgO |
| Оксид меди II | CuO |
| Оксид натрия | Na2O |
| Оксид ртути II | HgO |
Физические свойства основных оксидов:
Общим физическим свойством для всех основных оксидов является то, что они представляют собой твердые вещества. В то время как другие: внешний вид, цвет, плотность, температуры плавления и кипения, молярная масса, твердость и пр. различаются.
| Название оксида: | Химическая формула: | Внешний вид: |
| Оксид бария | BaO | бесцветные кристаллы |
| Оксид калия | K2O | твердое бесцветное или бледно-желтое вещество |
| Оксид кальция | CaO | белое кристаллическое вещество |
| Оксид лития | Li2 O | бесцветные кристаллы |
| Оксид магния | MgO | твердое белое вещество |
| Оксид меди II | CuO | твердое черное вещество |
| Оксид натрия | Na2O | бесцветные кристаллы |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
Получение основных оксидов:
Основные оксиды получаются в результате:
- 1. окисления металлов кислородом (кроме благородных):
2Сa + О2 → 2CaО (t = 300 o C);
- 2. термического разложения гидроксидов:
Ba(OH)2 → BaO + H2О (t = 780-800 o C);
Сa(OH)2 → СaO + H2О (t = 520-580 o C);
- 3. термического разложения солей:
BaCO3 → BaO + CO2 (t = 1000-1450 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
Химические свойства основных оксидов. Химические реакции основных оксидов:
Для основных оксидов характерны следующие общие химические реакции:
1. взаимодействие с водой.
В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп периодической таблицы химических элементов Д.И. Менделеева (натрий, калий, кальций, барий и др.).
В результате взаимодействия основных оксидов с водой образуются основания.
MgО + Н2О → Mg(ОН)2 (t = 100-125 o C);
2. взаимодействие с кислотными оксидами.
В результате химической реакции основных оксидов с кислотными оксидам образуется соль.
CaО + SiО2 → CaSiО3 (t = 1100-1200 o C);
MgО + SiО2 → MgSiО3 (t = 1100-1200 o C);
3. взаимодействие с кислотами.
В результате химической реакции основных оксидов с кислотами образуется соль и вода.
Аналогично проходят реакции основных оксидов и с другими кислотами.
4. взаимодействие с амфотерными оксидами.
В результате химической реакции основных оксидов с амфотерными оксидам образуется соль.
BaO + ZnO → BaZnO2 (t = 1100 o C);
BaO + SnO → BaSnO2 (t = 1000 o C);
5. восстановление до простых веществ:
BaO + Be → Ba + BeO (t = 270 o C);
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 o C);
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 o C);
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 o C);
3BaO + Si → 2Ba + BaSiO3 (t = 1200 o C);
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 o C);
Li2O + Mg → 2Li + MgO (t > 800 o C);
2Li2O + Si → 4Li + SiO2 (t = 1000 o C);
2MgО + Si → 2Mg + SiО2;
MgО + 2K → Mg + K2О;
MgО + Са → Mg + СаО (t = 1300 o C);
CuО + H2 → Cu + H2О (t = 300 o C);
CuО + С → Cu + СО (t = 1200 o C);
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
6. взаимодействие с галогеноводородами (бромоводородом, йодоводородом и пр.).
В результате химической реакции основных оксидов с галогеноводородами образуется соль и вода.
Коэффициент востребованности 11 310
- ← Суспензия, типы и виды, свойства, ее приготовление и разрушение
- Природное, искусственное топливо, различные виды →
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 914)
- Экономика Второй индустриализации России (105 113)
- Этилен (этен), получение, свойства, химические реакции (41 538)
- Крахмал, свойства, получение и применение (36 250)
- Целлюлоза, свойства, получение и применение (34 456)
- Природный газ, свойства, химический состав, добыча и применение (33 262)
- Программа искусственного интеллекта ЭЛИС (32 496)
- Прямоугольный треугольник, свойства, признаки и формулы (32 070)
- Метан, получение, свойства, химические реакции (31 815)
- Плазма, свойства, виды, получение и применение (30 534)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Основные оксиды

Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .

Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2

Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Источник: obrazovaka.ru