Медь, серебро и золото, образующие IВ группу ПСЭ.
Элементы подгруппы меди могут проявлять не только степень окисления +1, но и +2. Степень окисления +1 устойчива только для серебра. У меди появляется устойчивая степень окисления +2, а у золота степень окисления +3.
Медь получают пирометаллургическим восстановлением окисленных сульфидных концентратов.
Серебро получают при переработке полиметаллических (серебряно- свинцово-цинковых) сульфидных руд.
При ртутном способе золотоносную породу обрабатывают ртутью и получают амальгаму золота. Затем ртуть отгоняют, остается металлическое золото.
Свойства: в виде простых веществ медь, серебро и золото – очень пластичные, вязкие, хорошо тянущиеся в проволоку блестящие металлы соответственно красного, белого и желтого цветов. Медь и серебро обладают наивысшей среди металлов теплопроводностью и электропроводностью. В электрохимическом ряду эти металлы стоят за водородом, поэтому они не взаимодействуют с водой и кислотами-неокислителями.
Что такое лисий хвост и чем опасен диоксид азота?
В реакцию с кислородом вступает только медь, давая при нагревании до 673 К преимущественно оксид меди (II), а при более высокой темпера-туре — Cu2O.
Оксид меди (I) Cu2O (темно-красный) плавится без разложения, при прокаливании разлагается. Во влажном состоянии медленно окисляется кислородом воздуха. Оксид меди (I) взаимодействует с кислотами и щелочами, растворяется в концентрированном растворе аммиака.
Оксид меди (II) CuO (коричнево-черный) при прокаливании разлагается реагирует с кислотами, концентрированными щелочами. Можно получить при разложении нитрата меди(II).
Гидроксид меди (II) Cu(OН)2 выпадает в виде голубого осадка при обработке растворов солей меди(II) щелочами. Реагирует с разбавленными кислотами и концентрированными щелочами.
Большинство соединений Cu (I) легко окисляется даже кислородом воздуха, переходя в устойчивые соединения меди(II).
Для меди характерна степень окисления +2, поэтому число производных Cu (II) значительно больше, чем производных Cu (I). Для меди (II) характерны как катионные, так и анионные комплексы. В водном растворе ион Cu2+ существует в виде голубого аквакомплекса.
Соединения серебра (I); оксид, его свойства, нитарты, галогениды, их свойства. Комплексные соединения серебра, свойства и способы получения.
Для серебра устойчива степень окисления +1, поэтому наиболее рас- пространенными являются соединения Ag(I).
Оксид серебра (I) Ag2О темно-коричневый, при нагревании разлагается, реагирует с водой, образуя слабощелочной раствор. Проявляет амфотерные свойства. Реагирует с разбавленными кислотами, концентрированными щелочами и гидратом аммиака.
Получают Ag2О при действии раствора щелочи на соли Ag (I)
2 AgNO3 + 2NaOH= Ag2O↓ +2NaNO3 + H2O.
Большинство соединений серебра (I) при небольшом нагревании и при действии света легко распадаются, и это используется, например, для приготовления светочувствительных эмульсий.
Важное значение имеет нитрат серебра AgNO3, из которого получают все остальные производные серебра. В водном раствореAgNO3 не гидролизуется.
Кислотный оксид + вода = ??? Основной оксид + вода = ???
Из-за высокой устойчивости цианидных и тиосульфатных комплексов малорастворимые галогениды серебра взаимодействуют с KCN иNa2S2O3.
Соединений золота (I), свойства и способы получения. Соединения золота (III), оксид и гидроксид, галогениды, способы получения; комплексные соединения. Применение простых веществ и соединений.
Для золота характерна степень окисления +3.
Значительно реже встречаются соединения золота(I). Эти соединения легко окисляются даже кислородом воздуха и для них характерна реакция диспропорционирования. При нагревании они легко распадаются, разлагаются горячей водой. Реагируют с кислотами, щелочами и гидратом аммиака, вступают в реакции комплексообразования.
Из бинарных соединений золота (III) известны Au2O3, AuF3, AuBr3, Au(OH)3.
Основным исходным продуктом для получения других соединений золота(III) является AuCl3, который получают взаимодействием порошка Au с избытком Cl2 при 473К.
Галогениды, оксид и гидроксид Au (III) — амфотерные соединения с преобладанием кислотных признаков.
Оксид золота (III) Au2O3 коричнево-черный, термически неустойчивый, не реагирует с водой, но реагирует с кислотами и концентрированными щелочами с образованием комплексных соединений:
Au2O3 + 8HClконц. = 2H[ AuCl4 ] + 3H2O
Кислотный характер галогенидов Au (III) проявляется в их склонности к образованию галогеноауратов (III), большинство из которых хорошо растворимы в воде.
Особая склонность Au (III) к образованию анионных комплексов проявляется, например, при гидролизе галогенидов.
Для золота (III) известны также нитрато-, сульфато-, циано-,сульфи- доаураты (III) щелочных металлов.
Применение: Около половины добываемой меди используется в электротехнике. Важное значение имеют сплавы меди. Наиболее применимы латуни.
Главным потребителем серебра является электротехника и радио-электроника. Соединения серебра применяются в фотографии, медицине.
Медь и серебро часто используют в качестве катализаторов в различных органических синтезах.
Золото является эквивалентом денег и большая часть его находится в хранилищах банков. Главным техническим потребителем золота является радиоэлектроника. Золото используется также для изготовления зубных протезов, украшений, золочения.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
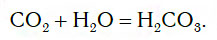
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
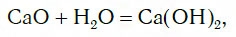
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
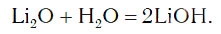
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
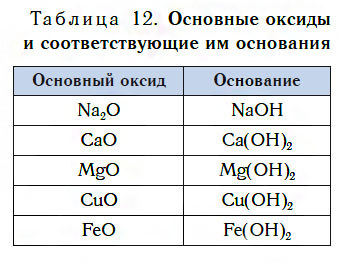
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
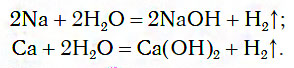
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: himi4ka.ru
ОКСИД ЗОЛОТА (III) (AU2O3): СТРУКТУРА, СВОЙСТВА И ПРИМЕНЕНИЕ — ХИМИЯ — 2023

Оксид золота (III) , представляет собой неорганическое соединение , химическая формула которого Au 2 O 3 . Теоретически можно было ожидать, что его природа будет ковалентной. Однако нельзя полностью исключить наличие определенного ионного характера в его твердом теле; или, что то же самое, предположим отсутствие катиона Au 3+ вместе с анионом O 2- .
Может показаться противоречивым, что золото, будучи благородным металлом, может ржаветь. В нормальных условиях куски золота (например, звезды на изображении ниже) не могут быть окислены при контакте с кислородом в атмосфере; однако, когда они облучаются ультрафиолетовым излучением в присутствии озона, O 3 , картина меняется.

Золотые звезды. Источник: Pexels.
Если бы золотые звезды были подвергнуты этим условиям, они приобрели бы красновато-коричневый цвет, характерный для Au 2 O 3 .
Другие методы получения этого оксида включают химическую обработку указанных звезд; например, путем преобразования массы золота в его соответствующий хлорид AuCl 3 .
Затем к AuCl 3 и остальным образовавшимся возможным солям золота добавляют сильнощелочную среду; и с этим получают гидратированный оксид или гидроксид Au (OH) 3 . Наконец, это последнее соединение термически дегидратируется с получением Au 2 O 3 .
Структура оксида золота (III)

Кристаллическая структура Au2O3. Источник: Materialscientist
На верхнем изображении показана кристаллическая структура оксида золота (III). Показано расположение атомов золота и кислорода в твердом теле с учетом либо нейтральных атомов (ковалентное твердое тело), либо ионов (ионное твердое тело). В любом случае достаточно удалить или разместить ссылки Au-O.
По изображению предполагается, что преобладает ковалентный характер (что было бы логично). По этой причине атомы и связи показаны сферами и полосами соответственно. Золотые сферы соответствуют атомам золота (Au III -O), а красноватые — атомам кислорода.
Если вы присмотритесь, можно увидеть, что есть единицы AuO 4 , которые соединены атомами кислорода. Другой способ визуализировать это — рассмотреть, что каждый Au 3+ окружен четырьмя O 2- ; конечно, с ионной точки зрения.
Эта структура является кристаллической, потому что атомы расположены в одной и той же схеме дальнего действия. Таким образом, его элементарная ячейка соответствует ромбоэдрической кристаллической системе (такая же на верхнем изображении). Следовательно, все Au 2 O 3 можно было бы построить, если бы все эти сферы элементарной ячейки были распределены в пространстве.
Электронные аспекты
Золото — переходный металл, и ожидается, что его 5d-орбитали будут напрямую взаимодействовать с 2p-орбиталями атома кислорода. Такое перекрытие их орбиталей теоретически должно генерировать зоны проводимости, которые превратят Au 2 O 3 в твердый полупроводник.
Следовательно, истинная структура Au 2 O 3 еще более сложна.
Увлажняет
Оксид золота может удерживать молекулы воды внутри своих ромбоэдрических кристаллов, что приводит к образованию гидратов. По мере образования таких гидратов структура становится аморфной, то есть неупорядоченной.
Химическая формула таких гидратов может быть любой из следующих, которые на самом деле до конца не выяснены: Au 2 O 3 ∙ zH 2 O (z = 1, 2, 3 и т. Д.), Au (OH) 3 или Au x O y (OH) z .
Формула Au (OH) 3 представляет собой чрезмерное упрощение истинного состава указанных гидратов. Это связано с тем, что в гидроксиде золота (III) исследователи также обнаружили присутствие Au 2 O 3 ; и поэтому бессмысленно рассматривать его отдельно как «простой» гидроксид переходного металла.
С другой стороны, аморфную структуру можно было ожидать от твердого тела с формулой Au x O y (OH) z ; поскольку он зависит от коэффициентов x, y и z, вариации которых приведут к появлению всех видов структур, которые вряд ли могут иметь кристаллический узор.
Свойства
Внешность
Это красновато-коричневое твердое вещество.
Источник: ru.sperohope.com