Добро пожаловать, Гость!
Готовимся к сдаче ЕГЭ по химии
Пероксид водорода
Пероксид водорода (перекись водорода), H2O2
— простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2 • 2H2O.
Строение молекулы
Молекула Н2O2 содержит в своем составе пероксидный анион O2 -2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
H +1 -O -1 -O -1 -H +1
Физические свойства
В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см 3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Экстримальный восстановитель 2
Химические свойства
Разложение Н2O2 (диспропорционирование)
2O -1 — 2e — → O2 0
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме:
(Кдисс = 1,5 * 10 -12 при 20°С)
Кислотные свойства проявляются в реакциях со щелочами с образованием солей — средних (пероксидов) и кислых (гидропероксидов), например:
Гидролиз пероксидов металлов
Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2:
Получение Н2O2 из пероксидов металлов
Так как Н2O2 — очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например:
Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде:
Окисление неорганических веществ
Источник: examchemistry.com
Экологически чистый способ извлечения благородных металлов из материалов, их содержащих
Изобретение относится к металлургии, а именно к способам извлечения благородных металлов. Способ извлечения благородных металлов из материалов, их содержащих, включает выщелачивание материалов раствором, содержащим хлорид-ионы, введение в выщелачиваемый раствор серной кислоты и перекиси водорода, последующую переработку продуктивного раствора с извлечением благородных металлов и возвращение переработанного раствора на выщелачивание. При этом серную кислоту и перекись водорода вводят в выщелачивающий раствор в виде смеси, причем смешивание осуществляют путем введения перекиси водорода в серную кислоту при молярном соотношение 2SO4 : H2O2 > 1 и при охлаждении. Использование изобретения позволяет снизить расход реагентов и повысить экологическую безопасность и чистоту процесса. 1 табл.
Экстримальный восстановитель
Изобретение относится к металлургии, а именно к способам получения благородных металлов, и может быть использовано для извлечения золота, серебра и металлов платиновой группы из руд, концентратов, огарков, хвостов, отработанных катализаторов, электронного лома и т.п.
Известен способ извлечения благородных металлов из руд, концентратов, отходов и вторичного сырья раствором, содержащим ионы H, Cl и NO3, например раствором, содержащим 50-350 г/л NCl и 3-50% HNO3 при температуре 20-110 o C. После выделения металлов из раствора отработанный раствор возвращают в процесс (DE 2418441).
Недостатками способа является большой расход азотной кислоты, т.к. для эффективности процесса необходима ее высокая концентрация, а также невысокая экологическая безопасность способа ввиду получения в качестве отходов окиси азота.
В качестве прототипа выбран способ извлечения благородных металлов из материалов, их содержащих, включающей обработку материалов оборотным выщелачивающим раствором смеси соляной и серной кислот с добавкой перекиси водорода с последующей переработкой продуктивного раствора («Rh, Pt and Pd Recovery from New and Apent Automative Catalysts» // Wu Koo Ying et. al. Precious Metals, 1993, N 17, p. 343-349).
В данном способе добавка перекиси водорода в раствор соляной и серной кислот приведет к повышенному расходу реагентов, что также повышает вероятность образования и выделения элементарного (газообразного) хлора в количестве, снижающем экологическую безопасность и чистоту процесса.
Задачей, решаемой изобретением, является снижение расхода реагентов и повышение экологической безопасности и чистоты процесса.
Решение поставленной задачи достигается тем, что в способе извлечения благородных металлов из материалов, их содержащих, включающем выщелачивание материалов раствором, содержащим хлорид-ионы, введение в выщелачивающий раствор серной кислоты и перекиси водорода, последующую переработку продуктивного раствора с извлечением благородных металлов и возвращение переработанного раствора на выщелачивание, серную кислоту и перекись водорода вводят в выщелачивающий раствор в виде смеси, причем смешивание осуществляют путем введения перекиси водорода в серную кислоту при молярном соотношении H2SO4:H2O2 > 1 и при охлаждении.
Сущность изобретения состоит в следующем. При введении в выщелачивающий раствор, содержащий хлорид-ионы, серной кислоты, как на холоду, так и при нагреве образуется смесь серной и соляной кислот по реакции 2Cl — + H2SO4 = SO4 2- + 2HCl (1) Окислительное действие перекиси водорода описывается полуреакцией H2O2 + 2H + + 2e = 2H2O, (2) значение стандартного окислительно-восстановительного потенциала (ОВП) которой равно + 1,776 в.
Кроме того, имеет значение порядок смешивания перекиси водорода и серной кислоты. Если вводить серную кислоту в перекись водорода, то при смешивании будет наблюдаться разбавление образующихся надсерных кислот водой и их разложение, вначале до перекиси водорода, а затем до кислорода. В результате будет происходить непроизводительная потеря используемой перекиси водорода.
Если же вводить перекись водорода в серную кислоту, то надсерные кислоты будут разбавляться серной кислотой, которая повышает их устойчивость. В результате конверсия перекиси в надсерные кислоты будет значительно более полной. По этим же причинам молярная концентрация серной кислоты в готовой смеси должна превышать молярную концентрацию перекиси водорода. Другими словами, готовая смесь должна содержать молярный избыток серной кислоты в соответствии с реакцией (6), т.е. должно соблюдаться соотношение H2SO4:H2O2 > 1.
При введении в выщелачивающий раствор перекиси водорода в виде смеси с серной кислотой полученные надсерные кислоты разлагаются, но значительно медленнее, чем сама перекись водорода. Кроме того, перекись водорода разлагается на кислород и воду, а надсерные кислоты в значительной степени разлагаются на озон.
И если кислород в этих условиях не является окислителем для благородных металлов, то образующийся озон также является окислителем, и более сильным и активным, чем перекись водорода. В результате предварительное смешивание перекиси водорода с серной кислотой приведет к одновременному активированию и стабилизации перекиси водорода. Следствием этого обстоятельства является реальная возможность поддерживать значительно меньшую концентрацию окислителя, кислоты и хлорид-ионов в выщелачивающем растворе, обеспечивая при этом растворение благородных металлов. В результате расход сократится.
ОВП образования элементарного хлора имеет значение +1,36 в и находится между значениями ОВП благородных металлов и перекиси водорода. Полуреакция образования хлора имеет вид
Cl2 + 2e = 2Cl — (7)
И хотя из полуреакции (7) следует, что вероятность образования элементарного хлора зависит только от концентрации хлорид-ионов, на самом деле она зависит и от кислотности раствора. Дело в том, что элементарный хлор гидролизуется с образованием хлорноватистой кислоты, имеющей ОВП значительно больший, чем у хлора (+1,63 в), а повышенная кислотность подавляет гидролиз и облегчает окисление хлорид-ионов в элементарный хлор. Поэтому если вести выщелачивание при повышенной кислотности и концентрации хлорид-ионов, то вероятность образования элементарного хлора повышается. И наоборот, при пониженной концентрации кислоты и хлорид-ионов эта вероятность снижается. Таким образом, возможность поддерживать меньшие концентрации окислителя, кислоты и хлорид-ионов при добавлении перекиси водорода в виде смеси уменьшает вероятность образования элементарного хлора и повышает экологическую безопасность и чистоту процесса.
Вся вводимая перекись водорода может смешиваться с частью всей вводимой серной кислоты, когда кислотность необходимо поддерживать относительно высокой, например при выщелачивании платины. В этом случае другая часть серной кислоты вводится в выщелачивающий раствор до добавления перекисной смеси.
В случае необходимости поддержания невысокой кислотности, например при выщелачивании рудного золота, вся перекись смешивается со всей вводимой серной кислотой и оба реагента добавляются в выщелачивающий раствор только в виде смеси. Соотношение количества перекиси водорода и серной кислоты в смеси может изменяться довольно широко: в зависимости от концентраций этих реагентов в исходных реактивах, а также от кислотной и восстановительной емкости выщелачиваемых руд и материалов.
Главное, чтобы и в ходе приготовления смеси, и по окончании в готовой смеси обеспечивался молярный избыток серной кислоты. Предпочтительно, чтобы перекись водорода содержалась в исходном реактиве в пределах 30-60%, а серная кислота — в пределах 92-98%.
При агитационном варианте процесса перекисная смесь может дозироваться непосредственно в выщелачиваемую пульпу как на холоду, так и при нагреве. В случае кучного и подземного выщелачивания благородных металлов смесь перекиси водорода и серной кислоты можно добавлять в выщелачивающий раствор непосредственно перед подачей его на выщелачивание руд. Источником хлорид-ионов в выщелачивающем растворе могут служить как хлориды щелочных и щелочноземельных металлов, так и соляная кислота, а также хлориды алюминия и другие хлориды. Переработка продукционного раствора осуществляется традиционными методами: сорбцией, электролизом или цементацией, с возвратом оборотного раствора на выщелачивание.
По известному и предлагаемому вариантам осуществляли обработку платиносодержащего алюмооксидного катализатора выщелачивающим раствором, содержащим хлорид алюминия. Обработку проводили при перемешивании на магнитных мешалках и температуре 80 o C в герметично закупоренных стеклянных сосудах. Сосуды были оборудованы приспособлениями для дозировки реагентов и отвода газов через гидрозатворы, заполненные раствором едкого кали 200 г/л. По известному варианту концентрации в растворе составляли: Cl — 8М, H2SO4 — 2,5М, 30% перекись водорода дозировалась в течение 1 часа в различном количестве из расчета от 10 до 100 г на 1 кг катализатора.
По предлагаемому варианту концентрации составляли: Cl — 2М, H2SO4 — 0,5М. Смесь 30% перекиси водорода и 92% серной кислоты готовилась из расчета: 1 объем серной кислоты и 1 объем перекиси водорода. Перекись водорода вводилась в серную кислоту при поддержании температуры смеси 15 o C охлаждением захоложенной водой.
Молярная концентрация серной кислоты в смеси составила -8,6 М, перекиси водорода -5 М, то есть смесь содержала значительный молярный избыток серной кислоты. Полученная смесь также дозировалась в течение 1 часа в различном количестве из расчета по перекиси водорода от 5 до 15 г на 1 кг катализатора. По окончании обработки по обоим вариантам пульпы отфильтровывались, в растворах определялись концентрации серной кислоты и платины, по которым рассчитывались степень извлечения и удельный вес серной кислоты. При этом в растворах едкого кали в гидрозатворах определялся активный хлор и рассчитывался удельный выход газообразного хлора в ходе обработки. Результаты представлены в таблице.
Из данных таблицы следует, что по известному варианту высокая степень извлечения платины 93,4% достигается только при удельном расходе перекиси водорода в 100 г/кг катализатора и серной кислоты 220 г/кг. При этом удельный выход газообразного хлора составил 14 г/кг. По предлагаемому варианту уже при удельном расходе перекиси водорода — 10 г/кг и серной кислоты — 121 г/кг извлекается 96% платины, а удельный выход газообразного хлора составил только 0,4 г/кг. Таким образом, по предлагаемому варианту значительно сокращается расход реагентов, а экологическая безопасность и чистота процесса повышаются.
Способ извлечения благородных металлов из материалов, их содержащих, включающий выщелачивание материалов раствором, содержащим хлорид-ионы, введение в выщелачивающий раствор серной кислоты и перекиси водорода, последующую переработку продуктивного раствора с извлечением благородных металлов и возвращение переработанного раствора на выщелачивание, отличающийся тем, что серную кислоту и перекись водорода вводят в выщелачивающий раствор в виде смеси, причем смешивание осуществляют путем введения перекиси водорода в серную кислоту при молярном соотношении H2SO4 : H2O2 > 1 и при охлаждении.
Источник: findpatent.ru
Перекись водорода ГОСТ 177-88
Перекись водорода (пероксид водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
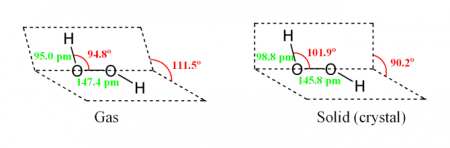
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обусловливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора H2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет йод из йодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганец при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении H2O2 образуется H2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с H2O2 используют в химическом анализе для определения содержания H2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Получение
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
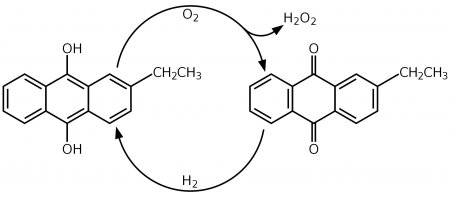
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия.
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта:
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H.
Применение

3 % раствор перекиси водорода
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов. Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также продлевает время заживления. Обладая хорошими очищающими свойствами, пероксид водорода на самом деле не ускоряет заживление ран.
Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также продлевать время заживления из-за повреждения прилегающих к ране клеток. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
Пероксид водорода применяется также для обесцвечивания волос и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно — разрушении тканей. Во время отбеливания зубов, однако, не происходит разрушения тканей. Пигментированные белки дентина начинают раскручиваться до первичной структуры (как если бы белок яйца из варёного стал более сырым), при этом связи не разрушаются, то есть этот процесс обратим. Эмаль сама по себе прозрачна, и эффект отбеливания достигается за счет разницы в отражении света дентином.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме.
С 90-х годов ХХ века 3%-ный раствор пероксида водорода продвигался целителем И. П. Неумывакиным для приёма внутрь как универсальное средство лечения и оздоровления человека. Научного подтверждения допустимости и эффективности данный метод не имеет.
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
Опасность применения

Кожа после попадания на неё концентрированного раствора перекиси водорода.
Несмотря на то, что пероксид водорода нетоксичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл.
Стоматологические препараты (АТХ код A01A )
- Натрия фторид
- Натрия монофторфосфат*
- Олафлур*
- Олова фторид*
- Натрия фторид в комбинациях с другими препаратами
Препараты для местного лечения заболеваний полости рта
- Водорода пероксид
- Хлоргексидин
- Амфотерицин B
- Полиноксилин*
- Домифен*
- Оксихинолин*
- Неомицин**
- Миконазол**
- Натамицин**
- Гексэтидин
- Тетрациклин**
- Бензоксония хлорид*
- Тибезония йодид*
- Мепартрицин*
- Метронидазол**
- Клотримазол
- Натрия перборат*
- Хлортетрациклин*
- Доксициклин**
- Миноциклин**
- Триамцинолон**
- Дексаметазон**
- Гидрокортизон**
- Эпинефрин**
- Бензидамин
- Ацетилсалициловая кислота**
- Адреналон*
- Амлексанокс*
- Бекаплермин*
* — препарат не зарегистрирован в России
** — препарат зарегистрирован, но соответствующие лекарственные формы отсутствуют
Источник: chem.ru