Коллоидные растворы – гетерогенные системы, состоящие из дисперсионной среды (непрерывная фаза), дисперсной фазы (прерывная) и стабилизатора.
Отличия от истинных растворов
Коллоидные (ультрамикрогетерогенные) системы
· Прозрачные, опалесцирующие – рассеивают свет, дают конус Тиндаля. Видимы в ультрамикроскоп.
· Фильтруются через бумажный фильтр
· Частицы задерживаются ультрафильтратами (целлофаны, пергамент)
· Относительно устойчивы, расслаиваются со временем
Молекулярные и ионные (истинные) растворы
· Прозрачные, неопалесцирующие, конус Тиндаля не наблюдается. Частицы не видимы в ультрамикроскоп.
· Частицы проходят через бумажный фильтр
· Частицы проходят через ультрафильтраты (мембраны)
· Устойчивы кинетически и термодинамически, не расслаиваются
КЛАССИФИКАЦИЯ
1. По размерам частиц

2. По агрегатному состоянию (границе раздела фаз)
Схема строения мицеллы


3. По характеру взаимодействия дисперсной фазы
с дисперсионной средой:
4. По структурно-механическим свойствам

По природе дисперсионной среды
Способы получения золей
I. Дисперсионные — из грубодисперсных систем (измельчение)
a) Механическое дробление — осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора.
b) Электрическое диспергирование — используют для получения золей металлов. При получении органозолей (дисперсионная среда – органический растворитель) применяют высокочастотный искровой заряд.
c) Измельчение с помощью ультразвука (дробление почечных камней)
d) Пептизация — раздробление свежеприготовленных рыхлых осадков на отдельные коллоидные частицы при добавлении небольшого количества электролита — пептизатора. Пептизация имеет биологическое значение: рассасывание атероскле-ротических бляшек, почечных и печеночных камней, действие антикоагулянтов при тромбофлебитах сводится, в сущности, к явлению пептизации
II. Конденсационные – из истинных растворов (укрупнение).
a) Физические — метод замены растворителя.
Раствор вещества прибавляют к жидкости, в которой растворенное вещество мало растворимо и выделяется в виде высокодисперсной фазы. Золи серы, холестерина и канифоли получают добавлением спиртовых растворов этих веществ к воде.
b) Химические


Формула мицеллы золя золота

Практическое занятие 1. Определение размеров частиц дисперсной фазы

мицелла MnO2 (при электрофорезе движется к аноду)





Гидролиз используют для получения золей гидроксидов тяжелых металлов, повышая температуру и с увеличивая разведение.

Молекулярно-кинетические свойства.
1. Броуновское движение
При рассматривании в микроскоп тонкой суспензии (мастика) или эмульсии (разбавленное водой молоко) наблюдается хаотическое, беспорядочное движения частиц.
Броуновское движение в коллоидах отражает характер и законы теплового движения обычных молекул и описывается уравнением А.Эйнштейна — М.Смолуховского (1906):

Процесс направленного движения вещества из области бóльших концентраций в область меньших.

Масса диффундирующего вещества прямо пропорциональна коэффициенту диффузии, площади поперечного сечения, градиенту концентрации и времени.
Формула Стокса-Эйнштейна

По коэффициенту диффузии (D) можно определить размер коллоидных частиц и величину макромолекул
Процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести
Закон Стокса

Исследование седиментационного равновесия проводят в ультрацентрифугах, которые позволяют превышать ускорение силы тяжести в сотни тысяч раз.
Формула Сведберга

Способность к седиментации выражают константой Сведберга (S) – отношением скорости оседания к ускорению свободного падения.
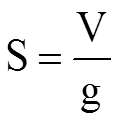
Единица измерения – Сведберг: S=1Сб=10 -13 сек
Ультрацентрифуги широко используются в химии белков, нуклеиновых кислот, вирусов и других клеточных структур для определения размера частиц и их фракционного состава.
Скорость оседания эритроцитов (СОЭ) – один из методов клинического анализа крови.
Проба свежей крови выдерживается в вертикально расположенном капилляре. Скорость оседания наблюдается визуально по перемещению окрашенной границы между слоями.
В норме СОЭ не превышает 10-12 мм/ч
При патологии СОЭ возрастает в связи с уменьшением агрегативной и седиментационной устойчивости крови.
4. Осмотическое давление
Величина, измеряемая минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Движущая сила осмоса — стремление к выравниванию концентраций.
Растворитель устремляется в область повышенной концентрации вещества. Процесс прекращается, когда давление становится равным атмосферному.
Закон Вант-Гоффа
Осмотическое давление пропорционально числу частиц растворенного вещества в единице объема раствора и не зависит от природы и массы частиц.
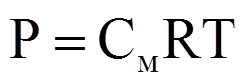
Осмотическое давление вещества в растворе равно тому давлению, которое оно оказывало, если бы находилось в том же объеме, будучи в газообразном состоянии.


Для 1М раствора любого вещества при T = 273 К; Росм = 2,27·10 6 Па (22,4 атм.).
Осмотическое давление коллоидных растворов незначительно и проводить наблюдения в обычных условиях очень трудно.
Коллоидная частица по сравнению с обычной молекулой обладает очень большой массой, поэтому при одинаковой массовой концентрации в коллоидном растворе содержится во много раз меньшее число частиц коллоида, чем в истинном растворе.
1%-ый коллоидный раствор золя золота с частицами в 1 ммкм имеет осмотическое давление, примерно в 20 раз меньше, чем 1%-ого раствора сахара при этих же условиях.
Источник: poisk-ru.ru
Большая Энциклопедия Нефти и Газа
Так, для сравнительно грубодисперсных золей золота характерно довольно слабое истинное поглощение в оранжевой области спектра; в ней же происходит и рассеяние света. Это приводит к синей или фиолетовой окраске таких золей в проходящем свете и красновато-бурому ( за счет некоторого изменения цвета при частичном поглощении рассеянных лучей) цвету опалесценции. По мере увеличения дисперсности золя область истинного поглощения сдвигается в желто-зеленую часть спектра, постепенно приближаясь к желтому спектру поглощения ионов AuClr. Поэтому с повышением дисперсности такие золи меняют свою окраску в проходящем цвете, становясь красными ( при размерах частиц около 40 нм) и, далее, зелеными и желтыми при очень высокой дисперсности; для таких золей характерен голубой цвет опалесценции. [16]
Так, для сравнительно грубодисперсных золей золота характерно довольно слабое истинное поглощение в оранжевой области спектра; в ней же происходит и рассеяние света. Это приводит к синей или фиолетовой окраске таких золей в проходящем свете и красновато-бурому цвету опалесценции за счет некоторого изменения цвета при частичном поглощении рассеянных лучей. [18]
Многие золи, например золи золота , серебра, трехсернистого мышьяка, дают прекрасные и очень яркие окраски. Причина этих различных окрасок еще неясна. Известно, что цвет золей тесно связан с размером частиц; теория этого вопроса развита Ми. Цвет зависит не только от размеров частиц, но и от их формы; асимметричные частицы дают цвет, который соответствует цвету, даваемому сферической частицей большей массы. [19]
Берестнева изучили процессы образования золей золота , V2O5 и др. ( см. стр. [21]
В отличие от методов получения золей золота , описанных в работах 4 и 5, этот метод дает, особенно при избытке таннина, сравнительно устойчивые, высокодисперсные золи золота, мало чувствительные к загрязнениям и позволяет получать золи без применения специально очищенной воды или посуды. [22]
В отличие от методов получения золей золота , описанных в работах 4 и 5, этот метод дает, особенно при избытке таннина, сравнительно устойчивые, высокодисперсные золи золота, мало чувствительные к загрязнениям, и позволяет получать золи без применения специально очищенной воды или посуды. [23]
Примером исключительной устойчивости могут служить часто упоминаемые красные золи золота в воде, не осаждающиеся через много месяцев или даже лет хранения в обычных условиях. [24]
В то время как метод получения золей золота и серебра основан на реакциях восстановления, для получения золей других элементов могут применяться также и окислительные реакции. [25]
Экспериментальная проверка этого уравнения при коагуляции золей золота , предпринятая Зигмонди, показала хорошее согласие теории с опытом. Медленная коагуляция идет часами и сутками, быстрая коагуляция протекает за время, определяемое долями секунды или секундами. [27]
Как следует из табл. 2, наиболее тонко дисперсные золи золота имеют красную окраску и размеры частиц от 20 0 до 50 0 ммк. [28]
В табл. 8 приведены данные о состоянии золей золота по истечении 18 часов после смешения с раствором желатины и скорости катафореза ( стр. В кислых растворах положительно заряженный белок сперва вызывает коагуляцию, точно так же, как это имеет место при смешении золей сернистого мышьяка и гидрата окиси железа ( стр. Дальнейшее прибавление желатины меняет знак частичек золота на обратный. В щелочных золях золота желатина имеет тот же знак, что и частички золота ( см. стр. Другими словами, осаждающая способность эмульсоидов, очевидно, является частным случаем взаимной коагуляции. [29]
Несколько ранее аналогичное исследование соотношения между окраской золей золота и размерами частиц было проведено Миура и Тамамуши [18], также применявшими серию золей с различными средними размерами частиц, определенными электропно-микроскопически. [30]
Источник: www.ngpedia.ru
Форум химиков
Как получить различные золи золота? Я знаю что существуют красные, синие, зеленые и другие золи золота, а как их получить?
Ответом на этот вопрос хотелось бы методику, а также их свойства, химических разумеется.
Сообщение pH » Вс мар 19, 2006 8:53 pm
Слышал только про HAuCl 4 + лимонная кислота.
Carpe diem
Сообщение adgaj » Пн мар 20, 2006 7:10 am
pH<7 писал(а): Слышал только про HAuCl 4 + лимонная кислота.
А что слышал?
Сообщение avor » Пн мар 20, 2006 3:35 pm
adgaj писал(а):
pH<7 писал(а): Слышал только про HAuCl 4 + лимонная кислота.
А что слышал?
кислота плюс лимонка
Кислота плюс формалин
Кислота плюс боргидрид натрия
Уменьшается размер от 30нм до 5нм конкркетные методики писать ломает вот если принесу книженцию и файнридер ее прочтет вышлю мылом если вас это еще интересует.
Сообщение adgaj » Пн мар 20, 2006 3:38 pm
avor писал(а):
adgaj писал(а):
pH<7 писал(а): Слышал только про HAuCl 4 + лимонная кислота.
А что слышал?
кислота плюс лимонка
Кислота плюс формалин
Кислота плюс боргидрид натрия
Уменьшается размер от 30нм до 5нм конкркетные методики писать ломает вот если принесу книженцию и файнридер ее прочтет вышлю мылом если вас это еще интересует.
Черезвычайнейшим образом интересует, желательно до 8 апреля
Re: Золи золота
Сообщение amik » Пн мар 20, 2006 10:29 pm
adgaj писал(а): Как получить различные золи золота? Я знаю что существуют красные, синие, зеленые и другие золи золота, а как их получить?
Ответом на этот вопрос хотелось бы методику, а также их свойства, химических разумеется.
Для начала Брауэр т.4 с.1102. Подробнейшая методика получения пурпурного золя золота с указанием дополнительной литературы.
И между прочим яндекс и др. поисковики рулят — сотни ссылок с методиками. Строка поиска «золь золота». Задайте без кавычек.
Re: Золи золота
Сообщение adgaj » Вт мар 21, 2006 6:11 am
amik писал(а): Для начала Брауэр т.4 с.1102. Подробнейшая методика получения пурпурного золя золота с указанием дополнительной литературы.
И между прочим яндекс и др. поисковики рулят — сотни ссылок с методиками. Строка поиска «золь золота». Задайте без кавычек.
Если бы все было так просто яб не спрашивал. В Брауэре красный золь, а Яндекс особо ничего не дает.
Re: Золи золота
Сообщение AndreyS » Пн апр 03, 2006 10:42 pm
adgaj писал(а):
Если бы все было так просто яб не спрашивал. В Брауэре красный золь, а Яндекс особо ничего не дает.
Цвет этих золей зависит от размеров частиц, а не от химического состава.
Re: Золи золота
Сообщение adgaj » Вт апр 04, 2006 1:11 pm
AndreyS писал(а):
adgaj писал(а):
Если бы все было так просто яб не спрашивал. В Брауэре красный золь, а Яндекс особо ничего не дает.
Цвет этих золей зависит от размеров частиц, а не от химического состава.
Ну это и индюку, который в супе, понятно. Золото оно и в Африке золото.
Вот только на размер частиц влияют те вещества из которых золото получали. Нужны конкретные методики, а не мысли вслух.
Re: Золи золота
Сообщение AndreyS » Вт апр 04, 2006 1:48 pm
Кстати, если Вас действительно интересуют золи золота, то в ChemRev несколько лет назад был очень хороший обзор по ним.
Re: Золи золота
Сообщение AndreyS » Вт апр 04, 2006 1:55 pm
Влияют прежде всего условия синтеза, а не «те вещества из которых золото получали». Классический метод Вам уже указали. Он до сих пор в основном и используеся, варьируются лишь восстановители и условия синтеза.
Разные варианты метода описываются в сотнях статей, многие из которых вполне доступны в инете.
Но если уж у Вас не получилось найти скопирую экспериментальную часть одной из статей (Size and temperature dependence of the plasmon absorption of colloidal gold nanoparticles, JOURNAL OF PHYSICAL CHEMISTRY B 103 (21): 4212-4217 MAY 27 1999, Times Cited: 142)
«The colloidal gold nanoparticles are prepared following a method introduced by Turkevich.21 A volume of 95 mL of a chlorauric acid (HAuCl4) solution containing 5 mg of Au are refluxed and 5 mL of 1% sodium citrate solution is added to the boiling solution. The reduction of the gold ions by the citrate ions is complete after 5 min while the solution is further boiled for 30 min and is then left to cool to room temperature. This method yields spherical particles with an average diameter of about 20 nm. Although the actual value of the mean size might vary slightly from each preparation, the size distribution is found to be always about 10% standard deviation.
Larger particles are produced by the reduction of HAuCl4 with hydroxylamine hydrochloride in the presence of already existing gold nanoparticles from the preparation described above.22 As the reducing agent hydroxylamine hydrochloride cannot act as a nucleating but only as a growth agent in slightly acidic conditions, the particle size of the existing particles is steadily increased. The 20 nm particles therefore form the nuclei of the larger ones. The size of the final particles is simply given by the amount of HAuCl4 used. A quantitative formula that allows one to estimate the final particle size is given by Turkevich.23
Gold nanoparticles with an average diameter of about 10 nm are prepared by reversing the order of addition of gold salt and sodium citrate.24 This means that in our preparation 68 mg of sodium citrate in 105 mL water are boiled and then 1 mL of aqueous solution containing 9.5 mg HAuCl4 is added. Boiling is then continued for 15 min. «
Re: Золи золота
Сообщение amik » Вт апр 04, 2006 3:00 pm
[/quote]Ну это и индюку, который в супе, понятно. Золото оно и в Африке золото.
Вот только на размер частиц влияют те вещества из которых золото получали. Нужны конкретные методики, а не мысли вслух.[/quote]
Вам уже неоднократно сказано, что в И-нете полно ссылок. Еще раз назвать посковые системы (Яндекс, Рэмблер, Гугл и др.)? Здесь на форуме, скорее всего, нет спецов по конкретной проблеме , но принцип подсказан. Нам решать проблему за Вас?
P.S. В Рэмблере уже при запросе «золи золота» в первых 20 ссылках находится и зависимость цвета от размера частиц и куча методик.
Сообщение shuttle » Вт апр 04, 2006 5:50 pm
Nu pochemu zhe net lyudei zanimayuschikhsya zolotimi nanochastitsami?
Ya zanimayus imi pryamo seichas.
Odnako na osnovnoi vopros uzhe est’ otvet — v google polno ssilok s metodikami. Odnako dopolnyu:
naibolee upotrebimaya seichas sistema — HAuCl4*3H2O smeshivaetsya s tiolami (razlichnimi). Obrazuyutsya promezhutochnie compleksi. Dalee Dobavlyaetsya NaBH4. Obrazuyutsya nanochastitsi stabilizirovannie (pokritie) tiolyatnimi fragmentami.
Chem menshe NaBH4 — tem krupnee chastitsi. I Ot tiolov razmer tozhe zavisit. Chem ikh bolshe — tem chastitsi menshe.
Сообщение shuttle » Вт апр 04, 2006 5:57 pm
Kstati naskolko seryezen interes adgaj k zolotim nanochastitsam? chto planiruete s nimi? esli seryezno — mogli bi posotrudnichat’. ya organic, organikoi chastitsi chasto modifitsiruyut dlya pridaniya khoroshikh svoistv.
I rabotaem mi ryadom.
eukar
Сообщение eukar » Вт апр 04, 2006 5:58 pm
Просьба — пользуйтесь http://www.translit.ru/ — ваши сообщения будет легче читать!
Сообщение AndreyS » Вт апр 04, 2006 6:15 pm
shuttle писал(а): ya organic, organikoi chastitsi chasto modifitsiruyut dlya pridaniya khoroshikh svoistv.
Вопрос из праздного любопытства — а какие именно свойства придают золоту хитрые органики?
Всегда думал что с золями золота работают неорганики и физхимики. Оказывается и органики используют сей хлебный продукт.
Сообщение shuttle » Вт апр 04, 2006 11:12 pm
органики делают золотые наночастицы водорастворимыми, парамагнитными, пе-аш-чувствительными, обладающими сродством к белкам, нелинеино-оптически активными и еще много много какими.
Сообщение AndreyS » Вт апр 04, 2006 11:58 pm
shuttle писал(а): органики делают золотые наночастицы водорастворимыми, парамагнитными, пе-аш-чувствительными, обладающими сродством к белкам, нелинеино-оптически активными и еще много много какими.
Все это делают и неорганики.
Я думал что вы туда что-то очень необычное сажаете.
Кстати, а как органики делают золи золота парамагнитными?
Сообщение shuttle » Ср апр 05, 2006 2:46 pm
я наверное уже вырос из возраста когда ученые делят друг друга на органиков — неоргаников — еще кого-то. вы можете четко провести грань между органиком и неоргаником?
если как вы говорите неорганики придают частицам свойства при помощи органических веществ — являются ли они неорганиками? или эти вещества становятся неорганичкскими? мне дележ совершенно не понятен.
а парамагнитными частицы можно делать хоть неорганикам хоть органикам — модифицируюя их носителями неспаренного спина. например, стабильными органическими радикалами (нитроксильными в частности).
они — золотые частицы- кстати, похоже, и сами парамагнитными могут быть.
Сообщение AndreyS » Ср апр 05, 2006 8:05 pm
shuttle писал(а): я наверное уже вырос из возраста когда ученые делят друг друга на органиков — неоргаников — еще кого-то. вы можете четко провести грань между органиком и неоргаником?
Четко не могу, да и не надо этого. Органики так органики. Хотя людей, занимающимися металлическими коллоидами и позиционирующими себя при этом органиками (кстати, а вы в каких журналах печатаетесь?) я до этого не встречал. Но это конечно же моя проблема.
Вспомнился мой руководитель диплома, который, занимаясь термодинамикой органических соединений, любил себя называть органиком.
- события — глобальные и локальные
- ↳ объявления и новости ChemPort.Ru
- ↳ что? где? когда?
- наука и технология / chemical scienceproduction
- ↳ автохимия и моющие средства
- ↳ лакокрасочные материалы и их рецептуры
- химический бизнес / chemical business
- ↳ снабжение лабораторий, предприятий и организаций
- ↳ Могу, умею
- ↳ барахолка
- ↳ вопрос-ответ
- ↳ инновации в химии
- ↳ ноу-хау от химиков — в бизнес
- ↳ требуется новое решение
- ↳ о работе
- ↳ работа на заказ
- ↳ Могу, умею
- ↳ барахолка
- химическое образование / chemical education
- ↳ обмен книгами, статьями, программами
- ↳ Сцыхаб
- ↳ Статьи и книги on-line
- ↳ Статьи и книги off-line
- ↳ Химические базы данных
- ↳ Полезные материалы от участников форума
- ↳ учеба — поступление, экзамены, зачеты и кафедры
- ↳ абитуриенты и первокурсники
- ↳ кафедры
- ↳ аспирантура
- ↳ химия в школе и вузе, помощь в решении задач
- ↳ Халява
- ↳ Репетиторство
- ↳ Лаборантская
- курилка
- ↳ лицом к лицу
- ↳ антихимия
- ↳ олимпиада-2010
Кто сейчас на конференции
Сейчас этот форум просматривают: нет зарегистрированных пользователей и 0 гостей
- Форум химиков
- Часовой пояс: UTC+03:00
- Удалить cookies
- Пользователи
- Наша команда
Источник: www.chemport.ru