На что похожа медь? Вопрос этот, вроде бы, из числа самых несложных. Внешнее сходство двух цветных металлов — золота и меди — общеизвестно. Но это как раз тот случай, когда житейские наблюдения не совсем в ладу с наукой. Как правило, мы не видим ни чистого золота, ни чистой меди — видим сплавы на основе этих металлов, причем в сплавах золота часто присутствует медь и порой в больших количествах.
Для того чтобы отличить слитки сравнительно легкой меди и тяжелого золота, не обязательно брать их в руки. Золото и медь очень сильно отличаются по цвету. Есть, правда, пурпурное золото, но это не самородок, а сплав. Есть золотистая латунь, и это тоже сплав, а не самородок. Чистое же золото — желтое, а медь красная.
Конечно, с точки зрения химии, у золота и меди немало общего, недаром же они занимают места в одной группе таблицы Менделеева. Но с белым металлом серебром у меди сходства больше, чем с желтым золотом.
Серебро и медь занимают первые два места по теплопроводности и электропроводности. Серебро и медь (в виде ионов) обладают сходным бактерицидным действием. Например, в глазных каплях против конъюнктивита используют и серебряную соль — нитрат серебра (ляпис), и медную—сульфат меди. Широко применяются медные соли в уходе за полостью рта.
где здесь ЗОЛОТО и МЕДЬ? все хотят их заиметь!
Так, популярная cj lion зубная паста в своем составе имеет ионы меди для более эффективного очищения зубов от налета. Так, формула известнейшего минерала меди халькопирита CuFeS2, и основная трудность при получении меди из него состоит в разделении меди и железа.
Для древнего человека медь была вообще главным металлом. Закономерен вопрос: почему именно медь, а не более распространенное железо, не серебро, олово, свинец или золото, а именно медь сыграла особую роль на ранних стадиях истории человеческого общества?
Из трех доисторических металлов, встречающихся в самородном состоянии, медь — самый распространенный. Холодной ковкой древний человек мог расплющить и упрочнить и медь, и серебро, и золото, но самый доступный металл из трех оказался и самым твердым. Щит Ахиллеса, как повествует Гомер, был выкован из меди.
Металловеды долго недоумевали, как это древний человек предпочел мягкую медь твердому кремню, но в конце пятидесятых годов советский историк С. А. Семенов с сотрудниками поставил сравнительный эксперимент. Из чистой меди были изготовлены топоры, ножи и другие немудреные инструменты, подобные тем, какими пользовался древний человек.
Такие же инструменты сделали из камня, и этими инструментами — каменными и медными — обрабатывали дерево. Оказалось, что медный топор втрое эффективнее каменного. Медным сверлом отверстие в березовом полене просверлили в 22 раза быстрее, чем таким же каменным сверлом. Были экспериментально доказаны преимущества медной пилы, медного долота, медных ножей.
Другая группа ученых проверяла, можно ли работать медью по меди. Кованная медь успешно прошла испытания.
Тем же экспериментальным путем историки доказали, что и в далекой древности люди могли выплавлять медь из некоторых руд. Как ни странно, первой медной рудой, из которой был выплавлен металл, скорее всего, был красивый поделочный камень малахит. Английский ученый Г. Р. Коглен смешивал куски малахита и древесного угля, поджигал уголь. Температура раскаленного угля 700—800 °С.
Разбор мелочевки. Медь, цветмет, золото и серебро
Этого достаточно для восстановления меди из малахита. Но в первых опытах Коглен смог получить лишь окись меди. Медь из той же смеси удалось выплавить лишь в глиняном горшке, плотно закрытом крышкой. В первых опытах избыток кислорода окислял медь, теперь же кислорода недоставало, углерод превращался в CO, и угарный газ восстанавливал содержащуюся в малахите медь до металла. Эти опыты позволили сделать вывод, что металлургия меди зародилась лишь после того, как древние в своих попытках выплавить металл перешли от костра к горну.
Когда это случилось? На этот вопрос нет однозначного ответа. Народы разных континентов и даже отдельных территорий не одновременно переходили от каменного века к медному. Пять тысяч лет назад построена гигантская пирамида Хеопса. Ее сложили из каменных глыб массой по 2,5 тонны каждая, и таких глыб было выточено почти 2,5 миллиона.
Вырубали и обрабатывали эти глыбы медным инструментом. Это значит, что III тысячелетие до н. э. было в Древнем Египте уже не началом, а расцветом медного века. А у индейцев Америки медный век наступил всего каких-нибудь 500 лет назад.
Медный инструмент приносит пользу и в наши дни. Чаще всего, конечно, пользуются не чистой медью, пусть даже прокованной, а медными сплавами, более твердыми и прочными. Слесарные работы, которые приходится иногда проводить во взрывоопасных цехах, например при производстве пороха, ведутся только таким не искрящим инструментом.

Более известны другие медные инструменты — оркестровые. Большой духовой оркестр носит с собой десятки килограммов меди (медных сплавов, конечно). Звучит медь и в симфоническом оркестре, и в джазе. Говорят, у знаменитого джазового трубача Луи Армстронга была золотая труба. Очевидно, это правда, но — лишь наполовину.
Сплав, из которого делали трубу, определенно содержал и медь. Видимо, лишь мифологические серебряные трубы архангелов были сделаны из чистого серебра (господь бог мог позволить себе и такое чудачество), реальные же духовые инструменты всегда делают из сплавов, чаще всего — сплавов на основе меди.
Сегодня медь — главный металл электротехники. Передача сигнала через любой колодец связи проистекает исключительно по медным проводам. Широко используют медь и в приборостроении, в конструкциях самых современных инструментов науки. Приведу лишь один пример.
Одной из наиважнейших частей циклотрона—ускорителя частиц и ионов, в котором получают новые химические элементы являются так называемые дуанты. Это полые вакуумные сосуды из меди, в которых и происходит ускорение частиц. Дуанты делают медными по двум причинам: из-за высокой теплопроводности и немагнитности меди.
Медь — жизненно важный элемент, необходимый для нормального развития растений, животных, человека. Она входит в состав некоторых ферментов и выполняет в биохимических реакциях роль активатора. В растениях медь участвует в процессе фотосинтеза: она влияет на усвоение растениями азота, а следовательно, и на синтез белков. Соединения меди в качестве микроудобрений вносят под посевы злаков. Особенно важна эта добавка на торфяных почвах, в которых почти нет меди.
В почву медные удобрения вносят главным образом в виде пиритных огарков раз в 4—5 лет по 5—6 центнеров огарков на гектар. При концентрации 0,3—0,6% Си пиритные огарки привносят в почву медь, которой растениям хватит на несколько лет. Иногда вместо пиритных огарков используют медный купорос, который заодно служит и средством борьбы с грибковыми заболеваниями растений.
В организме человека меди содержится немного — около 100 мг. Этот элемент рассредоточен почти по всему организму: медь есть в крови и костномозговой жидкости, в печени и в костях. В малых дозах медь положительно влияет на обмен веществ и кроветворную деятельность костного мозга, но в больших дозах она для нас ядовита (как и многие другие металлы).
То же самое можно сказать и о роли меди в жизни высших животных.
А вот в организмах моллюсков и ракообразных медь встречается в значительно больших количествах; там на ее долю приходятся десятые доли процента массы крови этих существ. В их организмах нет гемоглобина, его функции—связывание и перенос кислорода выполняет другой белок гемоцианин. Взаимодействие гемоцианина с кислородом обусловлено заключенными в его сложных молекулах ионами меди. Неокисленный гемоцианин бесцветен; окислившись, он принимает голубовато-синюю окраску, характерную для многих соединений меди. Вот почему у осминогов кровь голубая в прямом смысле этого слова.
Источник: a-smirnov.ru
9. Биологическая роль d-элементов iб-группы. Применение их соединений в медицине.
Медь Сu — необходимый микроэлемент живых организмов. Серебро Аg и золото Аu — примесные микроэлементы. Их соединения применяют в медицине.
Медь — биогенный элемент, содержится в тканях животных и растений. Общая масса меди в организме взрослого человека примерно 100 мг, что составляет около 0,0001%. Примерно 30% этого количества содержится в мышцах. Печень и мозг также богаты медью. Металлическая медь и ее соединения токсичны.
Наиболее важными с физиологической точки зрения являются медьсодержащие белки — цитохромоксидаза и супероксиддисмутаза.
Цитохромоксидаза — один из компонентов дыхательной цепи, локализованной в мембранах митохондрий. Обеспечивает клеточное дыхание, восстанавливая кислород до воды на конечном участке дыхательной цепи.
Цитохромоксидаза (М, = 200 000) состоит из семи белковых субъединиц и четырех связанных с ними активных центров: двух молекул тема, связывающих ионы железа, и двух ионов меди, непосредственно связанных с белковыми субъединицами. Такая структура цитохромоксидазы обеспечивает передачу четырех электронов из дыхательной цепи и осуществление реакции
О2 + 4Н + + 4е ~ →Цитохромоксидаза→ 2Н2О
При неполном восстановлении кислорода в дыхательной цепи образуется анион пероксида:
Взаимодействие этого аниона с органическими соединениями клетки приводит к образованию радикалов и нарушению нормального развития клетки.
Повреждающее действие аниона предотвращается медьсодержащим ферментом супероксиддисмутазой (СОД). Этот фермент катализирует реакцию
Интересно, что переносчиком кислорода у моллюсков и членистоногих является не гемоглобин, а гемоцианин (от греч. кианос — лазурный). Кровь этих животных имеет голубой цвет.
Гемоцианин в зависимости от биологического вида имеет различную молекулярную массу (у омара Мг = 825000) и состоит из большого числа белковых субъединиц (Мг от 25000 до 35000). Каждая субъединица имеет центры связывания кислорода. Эти центры представляют собой медьпротеиновые комплексы кислорода (биокластеры) с двумя ионами меди. Каждая такая пара связывает одну молекулу кислорода.
Ежедневно организму требуется 2,5—5,0 мг меди. При недостатке в организме меди может развиваться болезнь — медьдефицитная анемия. Медь необходима для усвоения железа, в частности, при синтезе цитохромоксидазы, которая содержит и железо, и медь. При дефиците меди нарушается нормальное развитие соединительных тканей и кровеносных сосудов.
Широкое применение меди и ее соединений в промышленности и сельском хозяйстве повышает риск отравления этими веществами. Отравления обычно связаны со случайной передозировкой инсектицидов, вдыханием порошка металла, заглатыванием растворов солей меди. Большую опасность представляют напитки, хранящиеся в медных сосудах без защитного покрытия стенок.
Токсическое действие соединений меди обусловлено тем, что ионы меди взаимодействуют с тиольными —SН-группами (связывание) и аминогруппами —NH2 (блокирование) белков. При этом могут образовываться биокластеры хелатного типа:
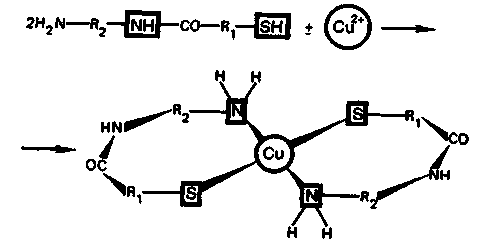
Вследствие таких взаимодействий белки становятся нерастворимыми, теряют ферментативную активность. В результате нарушается нормальная жизнедеятельность.
В качестве наружного средства применяют 0,25%-ный водный раствор сульфата меди СuSО4 при воспалении слизистых оболочек и конъюнктивитах. Малые дозы этого препарата могут применяться во время приема пищи для усиления эритропоэза при малокровии.
Серебро и золото. В организме взрослого человека обнаруживается около 1 мг серебра, т.е. примерно 10 -6 % (1 ч. на миллион), и до 10 мг золота, т.е. примерно 10 -5 % (10 ч. на миллион).
Антисептические свойства растворимых солей серебра известны с древних времен. Священнослужители давно знали, что вода («святая») при хранении в серебряных сосудах долго не портится, т.е. не подвергается микробному загрязнению. В настоящее время это свойство «серебряной» воды используется моряками в дальних плаваниях.
Сильные токсические проявления у взрослого человека наблюдаются при приеме внутрь 7 г АgNO3.
Токсическое действие соединений серебра, как и в случае меди, обусловлено главным образом тем, что ионы серебра взаимодействуют с тиольными серо- и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ.
В водном растворе существуют только комплексные соли золота, например, Nа3[Аu(S2О3)2] и различные тиоловые бионеорганические комплексы.
Механизм токсического действия соединений золота аналогичен механизму токсического действия соединений меди и серебра. В соответствии с общим правилом для тяжелых металлов одной группы токсичность возрастает с увеличением атомного номера в ряду: Сu Аg Аu.
В медицине издавна используются такие препараты, как кристаллический серебро нитрат АgNО3 (ляпис) и его водные растворы. Давно известны также препараты коллоидного металлического серебра протаргол (8% Аg) и колларгол (70% Аg), которые представляют собой мелкодисперсные порошки с металлическим блеском. Каждая частица таких порошков представляет собой кристаллик восстановленного металлического серебра размером менее 1 мкм с белковой оболочкой из альбумина (протаргол) или коллагена (колларгол). Белковая оболочка защищает кристаллики серебра от слипания и обеспечивает их переход в водную среду (солюбилизирует).
Препараты серебра применяют как противовоспалительные, антисептические и вяжущие средства.
Источник: studfile.net
Эколого-геохимическая роль меди, золота, серебра
Все элементы подгруппы являются относительно химически инертными металлами. Характерны также высокие значения плотности, но оносительно небольшие температур плавления и кипения, высокая тепло- и электропроводность.
Прикрепленные файлы: 1 файл
«Брестский Государственный университет
имени А.С. Пушкина»
Кафедра физической географии
по курсу «Геохимическая экология»
ЭКОЛОГО-ГЕОХИМИЧЕСКАЯ РОЛЬ МЕДИ, ЗОЛОТА, СЕРЕБРА
студентка 3 курса
Вахильчук Анна Олеговна
Карпук Виктор Константинович
ВВЕДЕНИЕ
Подгруппа меди — химические элементы 11-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы I группы). В группу входят переходные металлы, из которых традиционно изготавливают монеты: медь Cu, серебро Ag и золото Au.
Все элементы подгруппы являются относительно химически инертными металлами. Характерны также высокие значения плотности, но оносительно небольшие температур плавления и кипения, высокая тепло- и электропроводность.
Особенностью элементов подгруппы является наличие заполненного предвнешнего (n-1)d-подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.
1. ЭКОЛОГО-ГЕОХИМИЧЕСКАЯ РОЛЬ МЕДИ
Красноватый пластичный металл. Число изотопов с учетом ядерных изомеров – 18. В природе распространены стабильные изотопы 63Cu и 65Cu (соответственно 69,17 и 30,83 %). Искусственные радионуклиды 64Cu и 67Cu короткоживущие (T1/2 = 12,7 ч. и 61,9 ч. соответственно). Радиус Cu+ – 96, Cu2+ – 72, атомный – 127 пм.
Основные линии в атомном спектре – 324,754 (AA), 327,39 нм.
Кларк меди в земной коре составляет 5 ·10–3 % (5,3 .10-3), в кислых породах – 1 ·10–3 , в основных – 1 ·10-2 , почве – 2 ·10–3 , золе растений – 2 ·10–2 %, речных водах – 7 мкг/л.
В глубинных соединениях медь одновалентная, как в первичных сульфидах и куприте (Cu2O). Все остальные минералы отвечают валентности два. Разноквантовый характер в строении двухвалентной меди типа купро ведет к высокой поляризации и энергии решеток соединений, понижению растворимости при осаждении гидратов, сильному поглощению абсорбентами, окраске комплексных солей, увеличению летучести галоидных соединений, понижению твердости минералов. Для одновалентных соединений меди характерна слабая, для двухвалентных – сильная миграция ионов. Легко растворимы галоиды и сульфаты меди, но ее осаждают ионы CO3, SiO4, PO4, AsO4.
Медь легко отделяется от магмы при дифференциации основных пород. При гидротермальном процессе главное осаждение меди происходит около 400–300 °С. Эндогенные магматические концентрации связаны с основным (сульфидные медно-никелевые, колчеданные) и кислым (скарновые, меднопорфировые) магматизмом.
В гипергенной обстановке медь фиксируется преимущественно анионами CO3, SiO3. Концентрации отмечены в зонах вторичного сульфидного обогащения, а также в терригенных осадках лагунных и дельтовых фаций.
Известно более 170 минералов меди, из них преобладают сульфиды (47 %), фосфаты (35 ), сульфаты (18 ) и галоиды (18 %). Промышленное значение имеют: самородная медь Cu (92 %), халькопирит (CuFeS2 – 4,5 ), борнит (Cu5FeS4, – 63,3); халькозин (CuS2 – 79,8), кубанит (CuFe2S3 – 22–24), ковеллин (CuS – 66,5), куприт (Cu2O – 88,8), малахит (CuCO3 Cu(OH)2 – 57,4), азурит (2CuCO. Cu(OH)2 – 55,3 %). Геохимические барьеры меди: сорбционный, нейтральный, восстановительный, термодинамический. Хорошо мигрирует в кислых водах окислительной и восстановительно-глеевой обстановок в форме комплексных соединений.
В организме человека содержится 72 мг меди: в печени – 30 %, кости и мышцы – 30 %. Суточное потребление с пищей 2–6 мг. Период полувыведения – 30 суток. Токсичная доза – более 250 мг.
Медь занимает второе место после железа в качестве катализатора окислительно-восстановительных процессов, кроветворения (участвует в синтезе коллагена, эластина, гемоглобина); в фагоцитозе; коррегирует функции витаминов A, B, P, PP, C; стабилизирует тиоловые группы. Голубая кровь с гемоцианином содержит медь. Улучшае работу аминокислоты тирозина.
Естественные источники: телячья и баранья печень; эмментальский сыр, какао, пивные дрожжи, огурцы, фундук, шиповник, устрицы, рыба, соя, чечевица. Чем больше меди в пище, тем она хуже всасывается. Абсорбция меди ухудшается в присутствии элементов Mo, Ca, Zn, Cd, Pb, Mn.
Заболевания, вызванные недостатком меди: дисплазия соединительной ткани, нейродегенерация, гипохромная анемия, экзема.
Растения-концентраторы меди: бобовые.
Используется в технике и электронике.
2. ЭКОЛОГО-ГЕОХИМИЧЕСКАЯ РОЛЬ ЗОЛОТА
Мягкий пластичный металл желтого цвета, устойчив к окислению. Число изотопов золота с учетом ядерных изомеров 39. Распространен в природе изотоп 197Au (100 %). Искусственных радионуклидов три: 195Au – (Т1/2 = 186,1 дня), 198Au – (Т1/2 = 2,693 дня), 199Au – (Т1/2= 3,14 дня). Распад идет с выделением β и γ частиц.
Радиус Au+ – 137,Au3+ – 91, атомный – 144,2 пм. Основная линия в атомном спектре201,200 нм.
Кларк золота в земной коре – 0,11 · 10–6 % (3,5 . 10–7), золе растений –1 · 10–4 %, речных водах – 0,02 мкг/л.
В химии известны две валентности золота – 1 и 3. Характерна сильная поляризация, а ионный радиус близок к радиусу серебра, что приводит к образованию их сплавов в природе, отчасти с медью. Высокая плотность металла приводит к накоплению золота в россыпях.
Все свойства золота приводят к тому, что оно механически распыляется и дает коллоидальные растворы. Для золота характерно комплекс о образование. Коллоидные растворы и органические соединения бактерицидны.
Главнейшие минералы редкого, но вездесущего золота: самородное состояние, в соединении с металлами платиновой группы, сульфиды, теллуристые и селенистые соединения.
Гранитная магма при охлаждении дает пегматитовый остаток и ряд высокотемпературных газовых выделений, которые пространственное отделяются от гранита и по мере охлаждения дают начало погонам дестиллята, из них для золотого процесса характерны четыре:
– отщепление от эффузивных пород с накоплением теллура, селена и серебра;
– высокотемпературные отщепления типичных кварцевых жил с сульфидами, кристаллизация которых начинается около 400–450 °С и дает наиболее типичные золотые месторождения;
– жильбертизация комплекса и образование кварцевых жил;
– в серии оловянных и вольфрамовых дестиллятов, следующих один за другим, образуется особый тип шеелито-золотых жил.
В эндогенных условиях золото имеет подкоровое происхождение, на что указывает высокий кларк в мантийных породах основного ряда, а также близкий к метеоритному (мантийному) изотопный состав С, О2, S, встречающихся в породах и рудах. Месторождения связаны с гранитоидами (гранодиоритами и плагиогранитами). Предполагается, что первоначально золото было привнесено в древние бассейны осадконакопления глубинными растворами и расплавами, затем происходила его концентрация в коровых очагах гранитной магмы. При длительном взаимодействии глубинных флюидных систем с золотоносными вмещающими толщами происходит многократная перегруппировка. Золото обособляется в подвижных постмагматических продуктах в форме тиосульфатных Au(S2O3)3– и хлоридных (AuCl2 2– и AuCl2 4–) комплексных водных растворов.
Процесс формирования крупных месторождений золота является многоэтапным и начинался часто в докембрии и завершался в фанерозое. Золото имеет тесное сродство с Ag и Cu, с которыми оно образует твердые растворы и интерметаллические соединения. В природных процессах золото, серебро и медь ассоциируют с двумя плеядами элементов, которые являются соседями в Периодической системе Менделеева. С одной стороны, это Ni, Pt, Pd, Os, Fe, связанные с основными магмами, с другой – Zn, Hg, Pb, Bi, концентрирующиеся в кислых и средних магмах. Поэтому золото приурочено к медно-никелевым и свинцово-цинковым месторождениям.
Метаморфизм приводит к перераспределению и концентрации золота в виде крупных месторождений. Значительную роль в этом играют флюидно-метаморфические процессы, которые происходят в зонах динамометаморфизма среди черносланцевых толщ, обогащенных золотом, и в зеленокаменных поясах. При метаморфизме образуются золотоносные конгломераты.
В экзогенных условиях происходит высвобождение золота из пород и руд и его накопление в зонах окисления некоторых сульфидных месторождений (в железных шляпах) и россыпях речного и прибрежно-морского происхождения.
Известно 27 минералов золота, включая самородные и интерметаллические (с Ag, Hg, Cu, Pb). Главный минерал – самородное золото. Оно образует обособления в виде зерен, пленок, дендритов, реже кристаллических агрегатов. Другие минералы, как правило, промышленными не являются. К ним относятся интерметаллические соединения: электрум AuAg, аурокуприд AuCu3, ауростибит AuSb2, родит Au(Rh, Ir, Pd), кюстелит Ag(Au) и теллуриды – калаверит AuTe2, сильванит (Au, Ag)Te4, креннерит (Au, Ag)Te2, петцит Ag3AuTe2 и другие.
Геохимический барьер – биогенный. Миграция механическая. Подвижность золота активизируется микроорганизмами. Они же способствуют его концентрации.
В организме человека содержится в коллоидной форме около 60мкг золота. Суточное потребление с пищей – 0,01 г. Период полувыведения 40–120 суток. Коллоидное золото угнетает функции костного мозга, ингибирует уреазу, пероксидазу, амилазу. В организме химически инертный. Самородное золото выявлено в биомассе железобактерий, микроскопических грибах.
Растения-концентраторы: кукуруза, конский щавель.
Используется в ювелирном производстве, в электронике.
3. ЭКОЛОГО-ГЕОХИМИЧЕСКАЯ РОЛЬ СЕРЕБРА
Мягкий металл с серебристым цветом. Число изотопов с учетом ядерных изомеров – 46. В природе распространены стабильные изотопы 107Ag (51,84), 109Ag (48,16 %). Искусственных радионуклидов два: 110Ag (Т1/2 = 249,8 д.), 111Ag (Т1/2 = 7,47 д.). Распад идет с выделением β и γ частиц. Радиус Ag+ – 113, Ag2+ – 89, атомный – 144,4 пм.
Основная линия в атомном спектре – 328,068 нм.
Кларк серебра в земной коре равен 0,07 · 10–4 % (7,3 .10–6), почве – 1 ·10–5, золе растений – 1 ·10–4 %, речных водах – 0,3 мкг/л. Серебро образует характерные ионы типа купро, с сильной поляризацией и валентностью в геохимии равной единице. По ряду свойств оно примыкает к палладию. Нерастворимые и комплексные соединения серебра по свойствам близкие к золоту и меди, а легкорастворимые соли – к натрию.
С сильной поляризацией связана слабая электролитическая диссоциация атомов серебра в водных растворах. Высокий атомный радиус серебра тождествен атомному радиусу золота, что обеспечивает широкий диапазон взаимных сплавов серебра и золота.
Тесная связь серебра отмечается с селеном, теллуром, сурьмой, мышьяком, в меньшей степени с висьмутом, таллием и галлием, а также с металлами – свинцом, золотом. Характерны галоидные соединения элемента с хлором, бромом, йодом. Минералы серебра в гипогенных условиях формируются при средних и низких температурах, начиная с геофазы пневматолитов средних и кислых магм.
Серебро входит в решетку сульфидов и сульфосолей меди и в состав теллуридов в небольших количествах. Ионы Ag входят в решетку самородного золота, достигая в экстремуме почти 50 мас.%. Оно может содержать до 20 % примесей различных металлов – Au, Cu,Fe, Bi, Sb, Hg.
Серебро образует пленки, дендриты, округлые, волосовидные выделения. Встречаются самородки массой до 20 т. Важное значение имеют (в %): аргентит AgS (87,1), электрум Au, Ag (15–50), прустит Ag3AsS3 (65,5), пираргирит Ag3SbS3 (65,5), пилобазит (Ag, Cu)16Sb2S11(62,1–84,9).
В эндогенных условиях серебро имеет ювенильный и мантийный источник и связан щелочно-базальтоидным магматизмом. В этом случае повышенные концентрации серебра встречаются в суьфидных медно-никелевых месторождениях. Собственно серебряные и серебряно-полиметаллические месторождения гидротермального генезиса связаны с магмами среднего и кислого состава, в том числе с вулканическими комплексами.
В вулканических областях рудоносные растворы, отлагающие серебро, могли иметь различное происхождение: магматическое, метеорное и океаническое. В гидротермальных растворах серебро находится в виде подвижных тиосульфатных и хлоридных комплексов.
В экзогенных условиях, в зоне окисления сульфидных месторождений, серебро переходит в раствор в виде сульфата или тиосульфата и переотлагается в самородной форме или в форме галоидов. В элювиальных, делювиальных и аллювиальных россыпях серебро на-капливается в незначительных количествах.
Известно более 62 минералов серебра, из них многочисленны сульфосоли (30), сульфиды (18), галоиды (10). Геохимические барьеры: восстановительно- сероводородный. Мигрирует в виде комплексного иона в кислых и щелочных водах окислительной обстановки.
В организме человека содержится 790 мкг серебра. Суточное потребление с пищей – 70 мкг. Период полувыведения – 80–160 суток.
В организме человека ионы серебра в количестве 0,5–1 мг/л в течение полуминуты ослабляют вирус гриппа, в течение часа убивают возбудителя брюшного тифа, дифтерии, стрептококка и стафилококка. Ионы серебра проникают внутрь клетки бактерии, образуют нуклеаты и клетка отмирает. Они угнетают образование аминокислот опухолевой ткани. Аналогично действуют ионы ртути и меди. В ферментных системах серебро блокирует тиоловые группы.
Источник: www.referat911.ru