ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Как проверить золото при помощи йода
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e — → Al 3+ — окисление
3│2 H + + 2 e — → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e — → 2Al 3+ — окисление
3│2 H + + 2 e — → H 2 – восстановление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:

Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .
Примеры:
Активный металл
4│2 Al 0 – 6 e — → 2 Al 3+ — окисление
3│ S 6+ + 8 e → S 2- – восстановление
Источник: www.chem-astu.ru
Реакция металлов с соляной кислотой: признак взаимодействия цинка, железа и меди
Известно доказанный факт, что соляная кислота взаимодействует с активными металлами. При этом часть веществ способна реагировать на такое соединение, другая часть остается нетронутой.
Неактивные металлы не могут реагировать на вещество: к ним относят золото, серебро, ртуть.
Соляная кислота представляет собой соединение хлора и водорода. Путем растворения в воде газообразного вещества под названием хлороводород получается данное соединение.
Ионы водорода при таком уравнении исполняют роль окислителя, что вызывает реакцию у активных металлов.
Какие вещества вступают в реакцию с соляной кислотой
На вступительных экзаменах по химии часто можно встретить задание на определение веществ, которые способны реагировать на соляную кислоту.
Кроме того, задание «составьте уравнение» нередко вызывает страх в глазах выпускников.
Чтобы не путаться с химическими задачами, рекомендуется подробнее изучить информацию о взаимодействии с данным соединением.
Все существующие вещества можно поделить на металлы, вытесняющие водород из соединения, не вытесняющие водород, а также активные и неактивные металлы.

В реакцию с соляной кислотой вступают такие вещества:
-
Химические основания. Соляная кислота способна нейтрализовать основания. Как известно, они состоят из атома металла, на который и воздействует кислота.
Кроме перечисленных веществ и соединений, HCl также способна реагировать на нитрат серебра – при таком взаимодействии образуется осадок белого цвета творожистого типа.
Признак взаимодействия с цинком, железом и другими металлами
Если курс школьной химии был успешно забыт, можно вспомнить о том, какие бывают признаки взаимодействия металлов, вступающих в реакцию с соляной кислотой.
Чтобы экспериментальные опыты не вызвали несчастного случая, рекомендуется заранее открыть все окна, вооружиться защитной одеждой, чтобы кожа рук была закрыта.
Также рекомендуется использовать перчатки и повязку на лицо.
Обратите внимание! Ниже будет рассказано о том, какие признаки говорят о вступлении в реакцию элементов с соединением.
Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией.

Рассмотрим, что происходит, если добавить немного кислоты на определенный вид металла:
| Металл | Признак взаимодействия |
| Цинк | Если опустить этот металл серебристого цвета в пробирку с указанным веществом, можно постепенно наблюдать выделение небольшого количества пузырьков и водорода. |
Как составить уравнение реакции
Одно из самых распространенных заданий на экзаменах и в контрольных работах – составить уравнение на реакцию HCl, в данном случае – соляной, с другими веществами или соединениями.

Чтобы не запутаться в решении, предлагаем несколько советов и шпаргалок для легкого запоминания:
- Запомните буквенное обозначение данного вещества – соляная кислота в химии обозначается как HCl: если вещество разбавленное, это указывается в скобках рядом.
- Как уже было сказано выше, вещество способно реагировать с активными металлами, стоящими до водорода в электрохимическом ряду; кроме того, она реагирует на основания, оксиды, гидроксиды и карбонаты.
- Химические основания обозначаются как OH, оксиды – O, гидроксиды – OH2, карбонаты – CO3.
- Уравнение реакции всегда будет иметь знак +, потому как в процессе взаимодействия происходит соединение нескольких компонентов.
- HCl может идти первым или вторым слагаемым, после прибавления металла, вещества идет знак =, после этого описывается реакция, где указаны продукты распада.
- Например, при реакции кислоты серы с сульфатом магния получается такое уравнение: Mg+H2SO4 = MgSO4+H2.
- Соляная кислота и гидроксид бария дают такое уравнение: 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
- При реакции соединения водорода, хлора и мела образуется хлорид кальция: СаСО3 + 2HCl = CaCl2 + СО2 + Н2О.
- Раствор карбоната натрия с кислотой выглядит так: HCl+Na2CO3=2NaCl+H2O+CO2.
Составить уравнение несложно, важно изначально правильно обозначить буквенные символы каждого элемента или вещества.
Важно! Необходимо правильно определить коэффициенты атомов в уравнении – их количество до знака = должно быть таким же, как и после знака =.
Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов.
Полезное видео
Источник: ladyvapm.com
Качественные реакции в органической химии
Качественные реакции в органической химии используются для быстрого распознавания класса соединения. Для таких реакций характерно проявление внешних эффектов — изменение цвета раствора, выпадение осадка или выделение газа.
Качественные реакции на алканы
- При горении алканов пламя становится голубым.
- Реакция окисления алканов перманганатом калия на холоде не идет – раствор не меняет цвет.
Качественные реакции на алкены
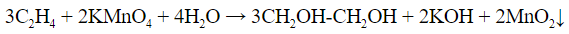
- Реакция Вагнера – обесцвечивание раствора перманганата калия, сопровождается выпадением темно-коричневого осадка диоксида марганца:
- Обесцвечивание бромной воды:

Качественные реакции на алкины
- Реакция Вагнера – раствор перманганата калия обесцвечивается и выпадает осадок черного цвета (диоксид магния):
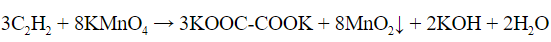
- Обесцвечивание бромной воды:
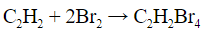
- С реактивом Толленса (гидроксид диамин серебра) только алкины с крайними тройными связями образуют осадок ацетиленида серебра. Алкины с другим расположением тройной связи в реакцию не вступают:
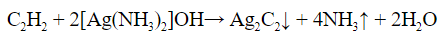
Качественные реакции на альдегиды
- Реакция серебряного зеркала с реактивом Толленса при нагревании — серебро покрывает зеркальным слоем стенки пробирки. При некачественном проведении эксперимента выпадает черный осадок мелкодисперсного серебра:

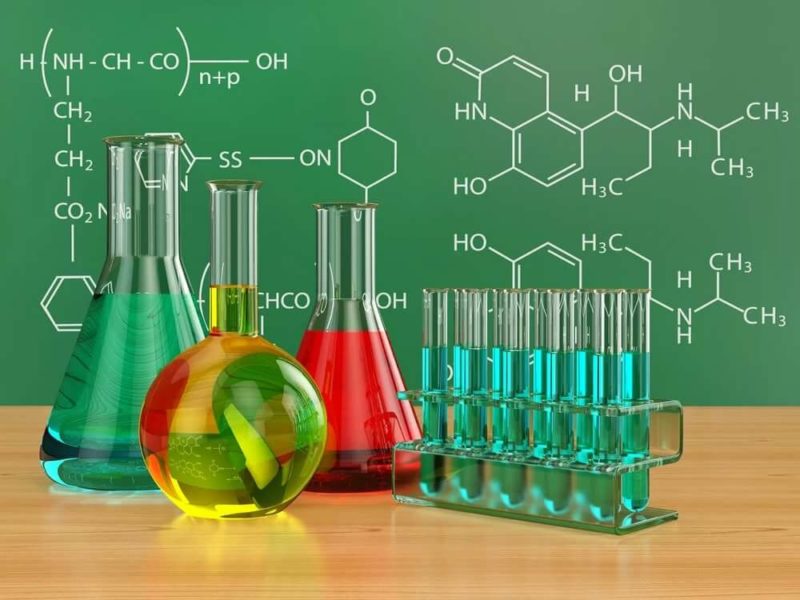
- Со свежеприготовленным гидроксидом меди при нагревании альдегиды образуют красно-оранжевый осадок оксида меди (I):
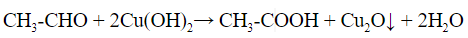
- С реактивом Несслера (щелочной раствор тетраиодомеркурата (II) калия) образуется осадок металлической ртути черного цвета:
- При взаимодействии бесцветных альдегидов с раствором бесцветной фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты делят на одно- и многоатомные (по количеству ОН-групп) и определяют с помощью разных качественных реакций.
1. Для одноатомных спиртов
1.1 С оксидом меди (II) — над раскаленным оксидом пропускают пары спирта, образуется альдегид, который выявляют пробой с фуксинсернистой кислотой – раствор окрашивается в характерный бледно-фиолетовый цвет:
1.2 Йодоформная проба – с йодом и гидроксидом натрия образуется йодоформ, осадок желтого цвета:

1.3. Проба Лукаса для выявления вторичных и третичных спиртов – первичные в реакцию не вступают. При взаимодействии одноатомных спиртов с концентрированным раствором соляной кислоты и хлорида цинка раствор расслаивается и образуется мутный маслянистый слой алкилхлорида:

2. Для многоатомных спиртов на примере глицерина
Голубой осадок гидроксида меди (II) при нормальных условиях растворяется в глицерине с образованием комплексного соединения меди ярко-синего цвета:

Качественные реакции на карбоновые кислоты
1. Фиолетовый раствор лакмуса карбоновые кислоты окрашивают в красный цвет.
2. Разложение под действием серной кислоты на угарный газ и воду. Выделяющийся угарный газ можно поджечь – он горит синим пламенем.
Для муравьиной кислоты:

Аналогично разлагается и многоосновная щавелевая кислота:
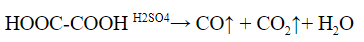
3. Реакция щавелевой кислоты с солями меди (II) – выпадает зелено-голубой кристаллический осадок оксалата меди:
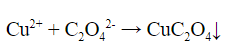
Качественные реакции на амины
- Фиолетовый раствор лакмуса амины окрашивают в синий цвет.
- Образование дыма в результате взаимодействия летучих аминов с газообразным хлороводородом.
- Первичные амины с хлороформом в щелочной среде образуют соединения – изонитрилы с характерным неприятным запахом:
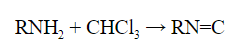
Качественные реакции на анилин
- При действии хлорной извести водный раствор анилина приобретает интенсивный фиолетовый цвет.
- При бромировании образуется белый осадок 2,4,6-триброманилина:

Качественные реакции на фенол
- При взаимодействии с хлоридом железа (III) раствор приобретает фиолетовый цвет:
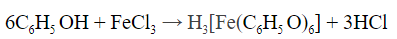
- С бромной водой образует твердый белый осадок 2,4,6-трибромфенола:

- При поликонденсации фенолов с альдегидами в кислой или щелочной среде образуются смолообразные полимеры и вода.
Качественные реакции на алкилхлориды
Проба Бейльштейна – качественная реакция определения хлора в органических соединениях.
Образец алкилхлорида на прокаленной медной проволоке помещают в пламя горелки, которое становится сине-зеленым.
Качественные реакции на углеводы
Углевод содержат альдегидные и гидрокси- группы — характерными будут реакции на спирты и альдегиды.
1. Крахмалсодержащие растворы под действием йода становятся синими.
- при нагревании раствор обесцвечивается;
- охлажденный – восстанавливает синий цвет.
2. Проба Селиванова определяет наличие фруктозы. В присутствии резорцина и соляной кислоты углевод приобретает красно-вишневый цвет.
Качественные реакции на белки
Цветные реакции позволяют выявить наличие белков в растворах.
- Ксанторотеиновая или Мульдера реакция выявляет в белке наличие аминокислот ароматического ряда (триптофана, тирозина и фенилаланина). Раствор обрабатывается концентрированной азотной кислотой – он окрашивается в желтый цвет; после добавления щелочи цвет изменяется на оранжевый.
- Реакция Фоля указывает на наличие аминокислот, содержащих слабосвязанную серу (цистина и цистеина). При кипячении белка со щелочью сера в виде сульфида свинца дает осадок бурого или черного цвета.
- Горение белка сопровождается запахом паленой шерсти. Качественные реакции в органической химии помогают с минимальными затратами определить, к какому классу соединений относится вещество.
Источник: allinchemistry.ru