Проскок электрона — отступления от общей для большинства элементов последовательности заполнения электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее), связанные с тем, что эти «нарушения правил» обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек «по правилам».
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р 3 ; р 6 ; d 5 ; d 10 ; f 7 ; f 14 ). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d- подуровня за счёт проскока (или провала) электрона с внешнего s- подуровня на нижележащий (предвнешний) d- подуровень (закономерные проскоки).
Таблица 4 – АВЗ элементов, характеризующихся провалом электрона
Атомная валентная зона
Теперь для этих элементов определим возможные валентные состояния.
Построим энергетическую диаграмму АВЗ для меди.
Количество электронов на энергетическом уровне

На этой диаграмме изображение s– электронов имеет чуть больший размер, чем d– электронов.
В таком состоянии медь одновалентна, так как присутствует только один неспаренный электрон. А на практике оказывается, что медь проявляет валентность, равную двум. Следовательно, возможно, вопреки правилу, перевести один проскочивший электрон с предвнешнего 3d– подуровня на внешний 4р– подуровень. В этом случае В * =2.

Поскольку остаётся ещё один неспаренный электрон на предвнешнем d– подуровне, то медь может быть, хотя и реже (так как этот электрон менее активен), трехвалентна.
Остальные 3d– электроны перевести на р– подуровень нельзя, поскольку это другой энергетический уровень.
Для золота характерна та же картина: В = 1; 2 * ; 3 * . Отличие заключается в том, что этот элемент стоит в шестом периоде и, следовательно, имеет больший радиус. Поскольку электроны ядром удерживаются слабее, то их оторвать проще. Поэтому золото чаще всего трёхвалентно, так как отдаёт сразу все электроны.
Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице. Объясняется это строением электронной оболочки палладия- элемента, который стоит перед серебром. Дело в том, что палладий — единственный элемент в таблице, у которого происходит провал не одного электрона, а сразу двух. То есть, электронная формула имеет вид 4d 10 5s 0 , вместо 4d 8 5s 2 . Поэтому номер периода не соответствует количеству уровней, так как нет электронов – нет уровня. Серебро идёт сразу за палладием и у него происходит стабилизация 4d– подуровня (электрон оттуда вернуться уже не может), а следующий электрон попадает уже на 5s– подуровень.
Энергетические уровни атома (видео 6) | Квантовая физика | Физика
Что касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма:
В данном случае s– электроны выделены более чётко, так как являются более активными. Поэтому при вступлении в связь хром и молибден отдают, как правило, не один, а сразу два электрона. Значит В * =2-6.
Можно привести достаточно большое количество незакономерных проскоков. Например, Ru : 4d 7 5s 1 (вместо 4d 6 5s 2 ), Pt: 5d 9 6s 1 (вместо 5d 8 6s 2 ) и так далее. Валентность рутения определяется по такому же принципу как и у хрома, а валентность платины – по такому же принципу как и у меди.
Источник: studfile.net
d-элементы
Эта тема часто бывает проблемной при подготовке к экзамену. Хотя она совсем не сложная.
Поэтому сначала я расскажу о «нелегкой доле российских учеников» — станет понятно, откуда «растут ноги» у этой проблемы, а потом разберем сам материал.
Все мы слышали об ИЮПАК (Международный союз теоретической и прикладной химии). Еще в 1989 году этот союз предложил для использования во всем мире (и весь мир согласился и до сих пор использует) так называемую «длинную форму» периодической системы элементов:
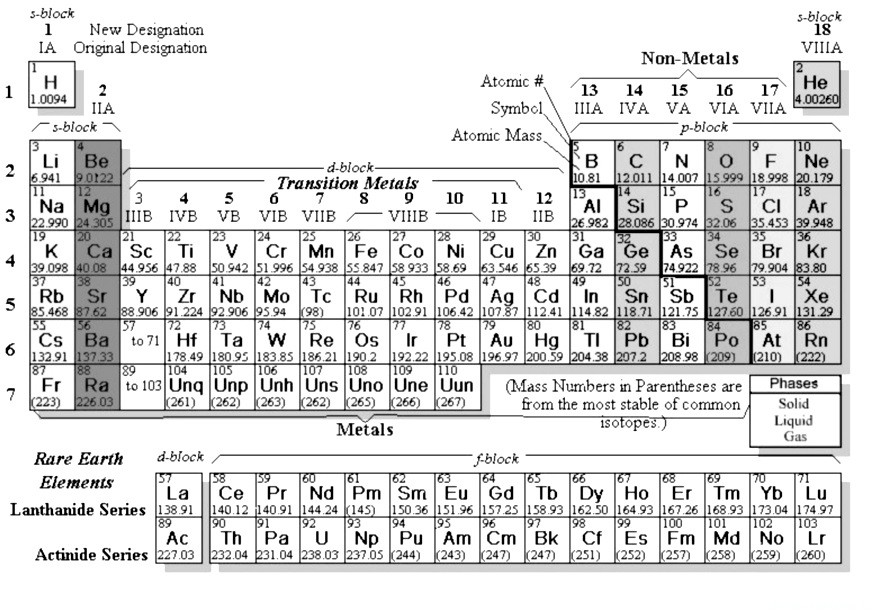
В России она почему-то не используется….
(На отсутствие цветов внимание не обращаем — на экзамене вам могут дать и черно-белый вариант)
- Нет подгрупп — есть только группы
- Количество групп — 18!
- d-элементы находятся между s- и p-элементами (d-block)
- соответственно, в периодах нет рядов — в них просто отпала необходимоcть
Эта таблица показывает последовательность заполнения электронами энергетических уровней.
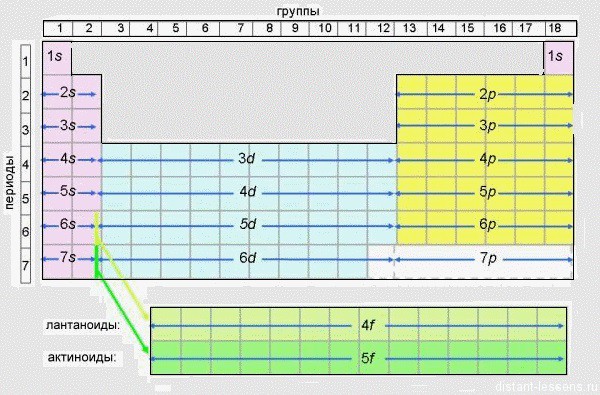
Эту табличку я очень рекомендую распечатать и активно использовать при подготовке к экзамену. На ЕГЭ, конечно, вам дадут «короткую» форму, но к тому времени вам уже легче будет ориентироваться по ней.
Итак, со вступлением мы разобрались, перейдем непосредственно к теме…
Строение электронных оболочек атомов
d-элементов
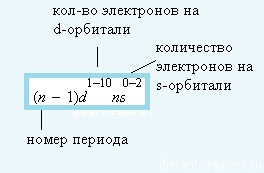
Это общая электронная формула этих элементов
Максимальное возможное количество электронов на d-подуровне — 10,
на s-подуровне — 2.
Особенности заполнения электронами подуровней:
4 период:

Обратите внимание, Sc — первый d-элемент и у него этот самый d — подуровень начинает заполняться электронами (s-подуровень уже заполнен).
У Cr вдруг появляется «аномалия» — 1 электрон на s-подуровне.
Тут срабатывает Правило Гунда:
заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Давайте «переведем»: чем больше количество неспаренных электронов, тем лучше!
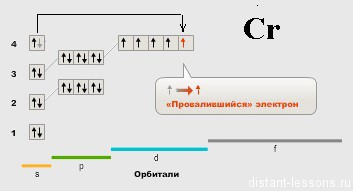
Электрон «проваливается» с S — подуровня, чтобы неспаренных электронов стало больше.
Дальше по периоду все идет нормально — планомерно заполняется электронами d-орбиталь.
У Cu и Zn d-подуровень заполняется полностью (10 электронов). Валентными будут электроны S — подуровня.
У других элементов тоже встречается такой «провал».
Следующие периоды мы подробно разбирать не будем, я просто приведу здесь табличку с электронными конфигурациями d-элементов.
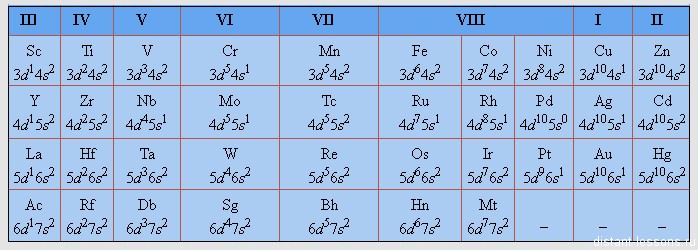
Потренируйтесь — распишите самостоятельно строение каждого из этих элементов!
Обсуждение: «d-элементы»
Святослав says:
12.12.2018 в 19:30
Известно много попыток классификации элементов по атомным массам с периодичностью октавы: Иоганн Дёберейнер(1929)У.Одлинг(1864), Дж.А.Ньюлендс(1865),Ю.Л.Мейера(1870), Д.И.Менделеев(1869)и т.д. Верное толкование химического сродства дано Дж.В.Гиббсом(1878),Я.Вант-Гоффом(1885). Конечно, в рукописи Меделеева «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»(1869)еще не было понимания октавной периодичности. Поэтому Дима не то чтобы предсказать, но даже правильно расположить не мог инертные газы.Пора остановить эту дележку заслуг,важно, что Таблица химических элементов Бора дает классификацию элементов, которая хорошо коррелирует с их свойствами.
Источник: distant-lessons.ru
Строение атома
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
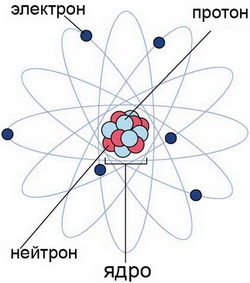
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A — Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра.
Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n — номер уровня.
В связи с этим максимальное число электронов на первом (n = 1) уровне равно 2 (так как N = 2 * 1^2), на втором (n = 2) уровне — 8 (так как N = 2 * 2^2), на третьем (n = 3) уровне — 18 (так как N = 2 * 3^2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Источник: school332.ru