Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень ( электронный слой ).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно (2n²), где (n )— его номер. Значит, на первом уровне может находиться не более (2) электронов, на втором — не более (8), на третьем — не более (18) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
Количество электронов на энергетическом уровне
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
Li 3 ) 2 ) 1 .
У следующих элементов второго периода электроны добавляются на второй уровень:
Be 4 ) 2 ) 2 ; B 5 ) 2 ) 3 ; C 6 ) 2 ) 4 ; N 7 ) 2 ) 5 ; O 8 ) 2 ) 6 ; F 9 ) 2 ) 7 ; Ne 10 ) 2 ) 8 .
У неона второй электронный слой завершён, так как содержит (8) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na 11 ) 2 ) 8 ) 1 ; Mg 12 ) 2 ) 8 ) 2 ; Al 13 ) 2 ) 8 ) 3 ; Si 14 ) 2 ) 8 ) 4 ; P 15 ) 2 ) 8 ) 5 ; S 16 ) 2 ) 8 ) 6 ; Cl 17 ) 2 ) 8 ) 7 ; Ar 18 ) 2 ) 8 ) 8 .
Максимальное количество электронов на третьем слое равно (18), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более (8) электронов.
Источник: www.yaklass.ru
Построение структурно-электронной формулы элементов B-подгрупп

Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Энергетические уровни. 8 класс.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
Количество электронов на внешнем уровне
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds
Все остальные элементы B-подгрупп, кроме палладия.
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
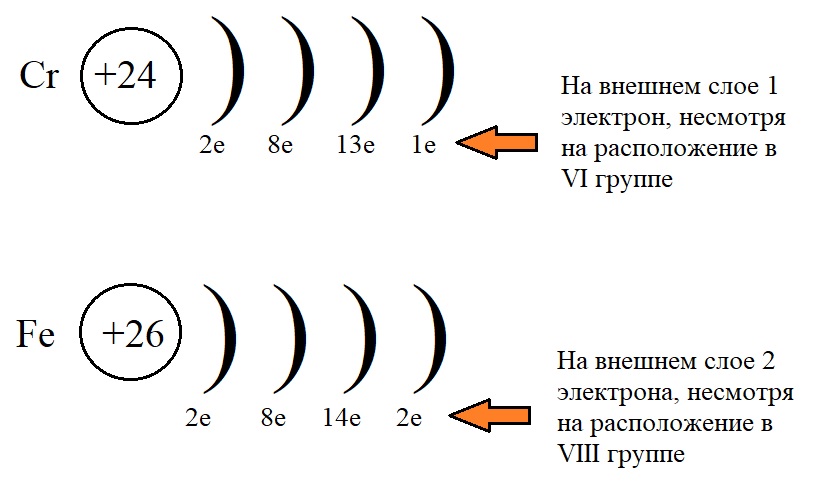
Конфигурация хрома и железа
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
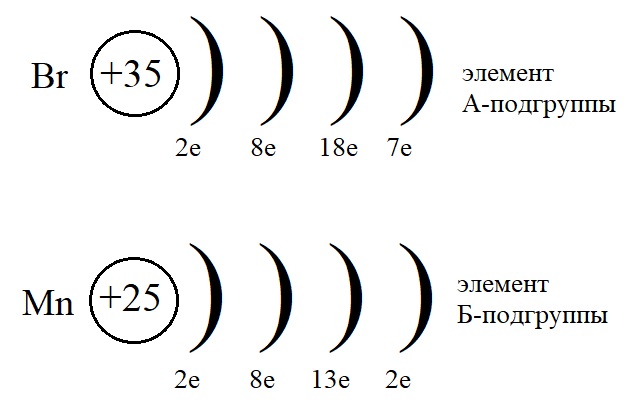
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
3s 2 3p 6 3d 5 4s 1
3s 2 3p 6 3d 6 4s 2
3s 2 3p 6 3d 5 4s 2
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s 2 3p 6 4s 2 3d 5 . s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns 2 (n-1) d 10
Решение задания:
Для начала разберемся со страшной формулой ns 2 (n-1) d 10 . Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s 2 (4-1)d 10 или 4s 2 3d 10 . Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d 10 4s 2 . Получившаяся формула приблизительна, вместо нее может быть 4d 10 5s 2 или 5d 10 6s 2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s 2 5p 3 , что соответствует структурно-электронной формуле:
Элемент имеет три неспаренных p-электрона.
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
Источник: onlineclass.space
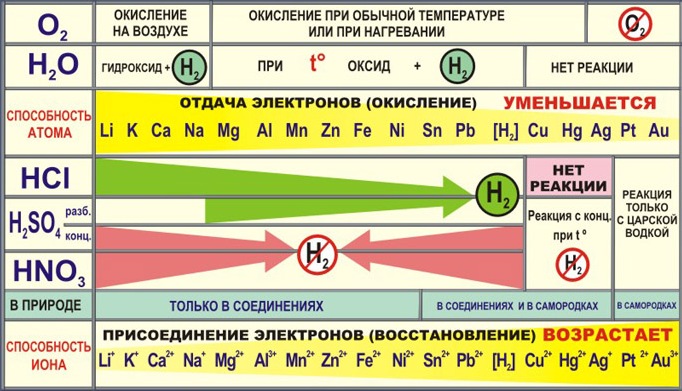
Положение в периодической таблице, строение атомов металлов.
Металлы в периодической системе химических элементов Д.И.Менделеева находятся в левом нижнем углу по диагонали B-At, а далее в побочных подгруппах. Исключение: Н, Ве, В.
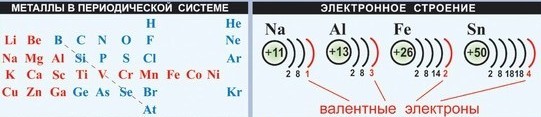
У металлов на последнем электронном слое от 1 до 3 электронов, следовательно, степень окисления от +1 до +3. Могут иметь степень окисления: +4, +5, +6, +7 металлы главных (IV — VI) и побочных подгрупп.
Восстановительные свойства в периоде ослабевают, радиус атома уменьшается, т.к. количество электронов на внешнем слое увеличивается. Увеличивается заряд ядра.
Восстановительные свойства в группе усиливаются. Число электронов на внешнем электронном уровне не изменяется. Радиус атома увеличивается, следовательно металлические свойства усиливаются.
— s — элементы -металлы I и II группы А (кроме Н и Ве).
— p — элементы — Al, Ga, In, Tl (внизу главной подгруппы).
— d — элементы -металлы побочных подгрупп.
— f — элементы лантаноиды и актиноиды.
Характерные физические свойства металлов.
— Металлический блеск (характерен не только для металлов: его имеют и неметаллы йод и углерод в виде графита);
— Возможность лёгкой механической обработки — пластичность; однако, некоторые металлы, например германий и висмут, непластичны;
— Высокая плотность (обычно металлы тяжелее неметаллов);
— Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы);
— В реакциях всегда являются восстановителями.
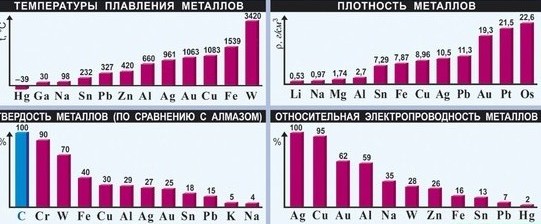
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако они обладают различной твёрдостью. Так, щелочные металлы легко режутся кухонным ножом, а такие металлы, как ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
Общие химические свойства.
- 1 Общие сведения о металлах
- 2 Простые вещества — металлы
- 3 Классификации металлов по химическим свойствам
- 4 Общие химические свойства металлов
- 5 Взаимодействие с простыми веществами-неметаллами
- 6 Взаимодействие со сложными веществами
- 7 Оксиды и гидроксиды металлов
- 8 Коррозия металлов
- 9 Способы защиты от коррозии
- 10 Способы получения металлов
- 11 Электролиз
- 12 Практическое задание
- 13 Металлы в природе
- 14 Интересные факты о металлах
Общие сведения о металлах
Вам известно, что большинство химических элементов от носят к металлам — 92 из 114 известных элементов.
Металлы — это химические элементы, атомы ко торых отдают электроны внешнего (а некоторые — и предвнешнего) электронного слоя, превращаясь я положительные ионы.
Это свойство атомов металлов, как вы знаете, определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от 1 до 3) на внешнем слое.
Исключение составляют лишь 6 металлов: атомы германия, олова, свинца на внешнем слое имеют 4 электрона, атомы сурьмы, висмута -5, атомы полония — 6.
Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7 до 1,9) и исключительно восстановительные свойства, то есть способность отдавать электроны.
Вы уже знаете, что в Периодической системе химических алементов Д. И. Менделеева металлы находятся ниже диагонали бор—астат, я также выше нее в побочных подгруппах. В периодах и глинных подгруппах действуют известные вам закономерности в изменении металлических, и значит, восстановительных свойств атомов элементов.

Химические элементы, расположенные вблизи диагонали бор -астат, обладают двойственними свойствами: в одних своих соединениях ведут себя как металлы, в других — проявляют свойства неметалла.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются. Сравните активность известных вам металлов I группы побочной подгруппы: Сu, Аg, Аu; II группы побочной подгруппы — и вы убедитесь в этом сами.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов этих металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
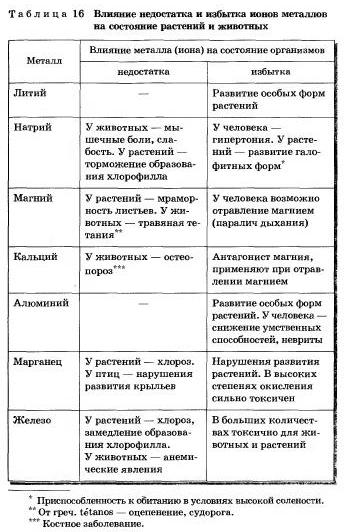
Простые вещества, образованные химическими элементами — металлами, н сложные металлсодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ноны) элементов-металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных, растений.
Например, в крови человека найдено 76 элементов и из них только 14 не являются металлами. В организме человека некоторые элементы-металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, то есть являются макроэлементами. А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден, присутствуют в небольших количествах, то есть это микроэлементы. Если вес человека 70 кг, то в его организме содержится (в граммах): кальция — 1700, калия — 250, натрия — 70, магния — 42, железа — 5. цинка — 3. Все металлы чрезвычайно важны, проблемы со здоровьем возникают и при их недостатке, и при избытке.

Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связало возникновение цивилизации («бронзовый век», железный век).
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000 ºС. в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.

И конечно же мы не должны забывать, что в большинстве сплавов используют давно известный металл железо (рис. 37), а основу многих легких сплавов составляют сравнительно «молодые» металлы: алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами, которые могут быть из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели, необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется.
На рисунке 38 изображена схема кристаллической решетки металла натрия. В ней каждый атом натрия окружен восемью соседними. У атомов натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов.
Единственный валентный электрон атома натрия Зs 1 может занимать любую из девяти свободных орбиталей, ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно нере-мещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такой тип химической связи называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
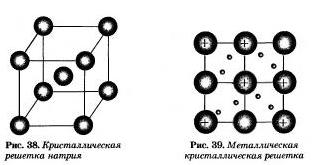
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически тик, как показано на рисунке узлах находятся катионы и атомы металлов. Обобществленные электроны электростатически притягивают катионы металлов, расположенные в у ал их кристаллической решетки, обеспечивая ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атом-ионами металле, расположенными в уллах кристаллической решетки, которая осуществляется обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать а нескольких кристаллических модификациях — называют полиморфизмом. Полиморфизм для простых веществ вам известен под названием аллотропия.
Олово имеет две кристаллические модификации:
• альфа — устойчива ниже 13,2 ºС с плотностью р — 5.74 г/см3. Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную):
• бетта — устойчива выше 13.2 ºС с плотностью р — 6,55 г/см3. Это белое олово.
Белое олово — очень мягкий металл. При охлаждении ниже 13,2 ºС он рассыпается в серый порошок, так как при переходе |1» п значительно увеличивается его удельный объем. Это явление получило название оловянной чумы. Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост злектрн чес кого сопротивления при повышении температуры, а также такие практически значимые свойства, как плотность, температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов. Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов относительно друг друга, в так как электроны перемещаются но всему кристаллу, разрыв связей не происходит, поэтому дли металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с коннлент-кыми связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов (рис. 40). Поэтому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это Аu, Af, Cu, Sn, РЪ, Zn. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы- Например, из золота можно изготовить золотую фольгу толщиной 0,008нм, в из 0,5 г этого металла можно вытянуть нить длинной 1 км.
Даже ртуть, к ото рея, как вы знаете, при комнатной температуре жидкая, при низких температурах я твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь Bi и Мn, они хрупкие.
Источник: infopedia.su