Нормальный электродный потенциал серебра равен 0,798 В. Чистое полированное серебро практически не изменяет свой цвет на воздухе. При обычной температуре Ag не взаимодействует с O2, N2 и H2. При действии свобод ных галогенов и серы на поверхности серебра образуется защитная пленка. Озон образует на поверхности Ag черный налет.
Хлор, бром, йод реагируют с ним даже при комнатной температуре. Расплавленное серебро может в очень больших количествах поглощать кислород, в про цессе охлаждения растворимость кислорода уменьшается, при этом образуется пористость, ухудшающая качество поверхности. Серебро стойко к коррозии в большинстве минеральных и органических кислот, в вод ных растворах галогенов.
Серебро также устойчиво в дистиллированной, природной и питье вой воде, в этиловом и метиловом спирте любой концентрации. В царской водке серебро не растворяется из-за образования защитной пленки AgCl. В отсутствие окислителей при обычной температуре HCl, HBr, HI не взаимодействуют с сере бром благодаря образованию на поверхности металла защитной пленки малорастворимых га логенидов. Кипящие едкие щелочи на серебро не действуют.
Интересно знать. Использование золота и серебра
Физико-механические свойства серебра
Серебро – металл белого блестящего цвета, мягкий и пластичный, хорошо поддается об работке давлением. Имеет гцк решетку, плотность при 20°С составляет 10,49 г/см3, темпера тура плавления 961°С (960,8°С). Различия в температуре плавления объясняются высокой растворимостью в серебре кислорода.
Серебро очень хорошо полируется, имеет наивысшую отражательную способность, оно отражает 94 % световых лучей, является самым электро- и теплопроводным металлом. Серебро прекрасно деформируется как в холодном, так и в горячем состоянии. Оно лег ко прокатывается в тончайшие листы до 0,00025 мм и вытягивается в очень тонкую проволо ку. Из Ag можно изготовить фольгу толщиной 2,5 мкм.
Свет, проходящий через фольгу, при обретает голубовато-зеленый оттенок. Серебро тверже золота, но мягче меди. Благодаря своим уникальным свойствам – высокой электропроводности и теплопровод ности, отражательной способности, светочувствительности – серебро имеет очень широкий диапазон применения. Растворяясь в золотом сплаве, серебро придает ему пластичность, блеск и облегчает пайку, однако изменяет цвет сплава и значительно повышает его цену.
Сплавы серебра для ювелирных изделий содержат два компонента – серебро и медь.
Медь. С повышением содержания меди до 28 % твердость и прочность сплавов Ag–Cu повышается, а пластичность падает. Цвет серебра с увеличением содержания меди становится все более желтоватым. Сплав серебра с 50 % меди становится красноватым, а с 70 % меди имеет красный цвет.
При добавке в сплав Ag–Cu других металлов он становится трех- или многокомпонент ным, что может существенно изменить его свойства: сделать более разносторонним в при менении или, наоборот, совершенно непригодным для использования. Золото. Сплавы Ag–Au обладают высокими литейными свойствами и стойкостью к окислению. Никель.
МАГИЧЕСКИЕ СВОЙСТВА ЗОЛОТА И СЕРЕБРА. ЧТО ЛУЧШЕ?
В сплавах серебра, применяемых в производстве ювелирных изделий, при со держании никеля до 1% замедляется рост зерна, и тем самым улучшаются их механические свойства. Железо всегда является нежелательной примесью в сплавах серебра. Железо присут ствует в сплавах в виде чужеродных частиц, ухудшающих обрабатываемость. Свинец.
Сплавы серебра, содержащие свинец, становятся при нагреве хрупкими, так как свинец и серебро при температуре 304°С образуют эвтектику, которая располагается по гра ницам зерен, что делает сплав красноломким. Олово. Даже небольшая добавка олова снижает температуру сплава, однако при этом сплав получается более тусклым, мягким и пластичным. Алюминий.
При содержании до 4-5 % алюминий не влияет на структуру сплава, при бо лее высоком содержании делает сплав хрупким, т.к. при этом образуется хрупкое соединение Ag3Al. При отжиге и плавке образуется также соединение Al2O3, которое, располагаясь по границам зерен, делает сплав хрупким и ломким. Кадмий. Сплавы с кадмием пластичны и устойчивы против коррозии на воздухе, не тускнеют и хорошо обрабатываются.

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса.
Источник: studopedia.info
Глава II
§ 1. Общая характеристика металлов и их физические свойства
Золото и серебро — металлы соответственно желтого и белого цвета. Они имеют гранецентрированную кубическую решетку, отличаются исключительной ковкостью и тягучестью. Так, прокаткой золотой пластинки можно получить фольгу толщиной 0,0001 мм. Такое тонкопрока-танное золото просвечивает и в проходящем свете кажется

зеленым. Из золота и сереора можно вытянуть проволоку 1,иаметром в 0,001 мм. Тепло- и электропроводность обоих металлов весьма высоки: серебро в этом отношении превосходит все другие металлы, золото уступает лишь меди и серебру. Близость размеров кристаллических решеток обоих металлов позволяет получать их ;плавы в виде непрерывного ряда твердых растворов. Давление Р паров золота значи-гельно ниже, чем серебра (рис. П. Летучесть сеоебпа
при высоких температурах довольно существенна и выше в окислительной атмосфере, чем в восстановительной.
Важнейшие физические свойства золота и серебра приведены в табл. 1.
Будучи d-элементами I группы периодической системы, серебро и золото, также как их электронный аналог — медь, имеют-в s-состоянии внешнего слоя по одному, а в предпоследнем слое по 18 электронов (s 2 p 6 d’°). При определенных условиях этот предпоследний 18-электронный слой способен к частичной потере электронов, поэтому медь, серебро и золото могут иметь в своих соединениях степень окисления не только +1, соответствующую потере s-электрона внешнего слоя, но также +2 и +3. При этом для меди наиболее характерны степени окисления +1 и + 2, для серебра +1 и Для золота +1 и +3.
Таблица 1. Важнейшие физические свойства золота и серебра
Гранецентрированная кубическая
Постоянная кристаллической решетки, нм .
Температура плавления, °С
Теплоемкость (при 25 °С), Дж/(моль-К) .
Теплота плавления, кДж/моль
Теплота испарения, кДж/моль
Теплопроводность (при 25°С), Вт/(м-К) .
Удельное электросопротивление (при 25 °С),
Твердость по Моосу (алмаз=10) . . .
Поэтому золото не растворяется ни в щелочах, ни в таких кислотах, как серная, азотная, соляная, плавиковая, а также органических.
Вместе с тем, в присутствии сильных окислителей золото способно растворяться в некоторых минеральных кислотах. Так оно растворяется в концентрированной серной кислоте в присутствии йодной кислоты Н5Ю6, азотной кислоты, диоксида марганца, а также в горячей безводной селеновой кислоте НгБеО^ являющейся весьма сильным окислителем.
Золото легко растворяется в царской водке, насыщенной хлором соляной кислоте, в водных растворах цианидов щелочных и щелочноземельных металлов в присутствии кислорода.
Как впервые показали И. Н. Плаксин и М. А. Кожухо-ва, хорошим растворителем золота является водный раствор тиомочевины, содержащий в качестве окислителя хлорид или сульфат железа (III).
Из других растворителей золота можно отметить хлорную н бромную воду, раствор иода в йодистом калии или иодистоводородной кислоте. Во всех случаях растворение золота связано с образованием комплексных соединений.
В своих химических соединениях золото может иметь степень окисления +1 и +3. Все соединения золота относительно непрочны и легко восстанавливаются до металла, даже простым прокаливанием.
Соединения золота (I)
Оксид золота (I) —порошок серо-фиолетового цвета, при температуре выше 200°С разлагающийся на элементы:
В воде А112О практически нерастворим, во влажном состоянии диспропорционирует на золото и Аи20з:
Оксид золота может быть получен только косвенным путем, например, действием на холоду водным раствором едкой щелочи на AuCl:
AuCl + КОН = AuOH + КС1. (3)
При осторожном нагревании (не выше 200 °С) полученный гидроксид переходит в Au20.
Гидроксид Au (I) заметно растворим в крепких щелочах с образованием ауритов, например Na[Au(OH)2]. В твердом состоянии ауриты не выделены.
Галиды золота (I)—довольно неустойчивые соединения. Они могут быть получены термическим разложением соответствующих галидов Au (III).
Хлорид Au(I), образующийся при осторожном нагревании (до 180— 190°С) хлорида Au(III),
разлагается на элементы уже при температуре выше 200°С и представляет собой порошок бледно-желтого цвета, медленно диспропорционирующий на металлическое золото и хлорид Au (III), даже при комнатной температуре:
3AuCl = 2Au + AuCl3. (5)
В присутствии влаги этот процесс резко ускоряется, причем образующийся хлорид Au (III) переходит в раствор, давая Н2[ОАиС13] (см. реакцию (14)).
В концентрированных растворах хлоридов щелочных металлов AuCl растворяется с образованием комплексных анионов AuClJ»:
Однако эти анионы также довольно быстро диспропорцио-нируют с выделением металла и образованием комплексных анионов Au (III) :
3 [AuCl2]~ = 2Au + [АиС1]Г + 2СГ.
Бромид золота (I) по своим свойствам сходен с AuCl. Он может быть получен нагреванием AuBr3 выше 200°С, однако уже при температуре выше 250 °С разлагается на элементы. Под действием влаги АиВг подобно AuCl, дис-пропорционирует на металл и AuBr3. В растворах бромидов щелочных металлов АиВг растворяется с образованием комплексных анионов [АиВгг] — .
Иодид золота (I) образуется при разложении АиЬ при комнатной температуре. При нагревании Aul разлагается даже легче, чем AuCl и АиВг. Наоборот, водой он разлагается медленнее, чем другие галогениды. В присутствии иодид-ионов Aul растворяется с образованием комплексных ионов [АиЬ] — . При действии раствора иода в водном растворе HI или KI на мелкодисперсное золота последнее растворяется, образуя комплексные анионы АиЬГ:
2Аи + 12 + 2Г = 2Аи1Г.
Иодидные растворы Au(I) применяют при переработке золотосодержащих отходов. Характерно, что в хлор- и бром
содержащих растворах золото растворяется в виде соединений Au (III) (см. ниже).
Сульфид золота (I) Au2S может быть получен действием сероводорода на подкисленный раствор K[Au(CN)2]:
Эта реакция обратима, и для ее протекания слева направо необходимо сильное насыщение раствора сероводородом. Сульфид золота нерастворим в воде и разбавленных кислотах, но растворяется в водных растворах сульфидов щелочных металлов, образуя комплексы [AuS] — и [AuS2] 3 ~. В кислой среде эти комплексы разрушаются с выпадением в осадок сульфида золота:
При нагревании до 240°С Au2S разлагается на элементы.
С рядом ионов и молекул золото (I) образует комплексные соединения. В качестве лигандов, кроме уже упоминавшихся ионов С] — , I — , S 2 ~ могут выступать также ионы CN — , S203 _ , SO| _ и др. Комплексообразование способствует повышению устойчивости производных золота (I) в водных растворах.
Наибольший интерес представляет весьма прочный ци-анидный комплекс Au(CN)F- Комплексные цианистые соли натрия, калия и кальция являются хорошо растворимыми соединениями и могут быть получены растворением металлического золота в водном растворе соответствующего цианида при доступе кислорода воздуха:
Эта реакция лежит в основе процесса цианирования — наиболее распространенного метода извлечения золота из коренных руд.
В кислой среде при нагревании анион Au(CN)i» разрушается с образованием нерастворимого в воде цианида золота AuCN:
Цианид золота — довольно прочное соединение. Оно не разлагается ни водой, ни разбавленными кислотами, но легко растворяется в присутствии цианидов щелочных металлов, лавая соответствующие комплексные соли:
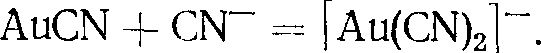
Из других комплексных соединений золота (I) можно отметить тиосульфатные и сульфитные комплексы, например, водорастворимые Na3[Au(S203)2]-2Н20 и Кз[Аи(S03)2] X ХН20.
Для гидрометаллургии золота значительный интерес представляет тиомочевинный комплекс золота
Au[CS (NH2)2] f. Он может быть получен растворением металлического золота в кислом водном растворе тиомочеви-ны в присутствии ионов Fe(III):
Au + 2CS (NH2)2 + Fe 3+ = Au [CS (NH2)2] t + Fe 2+ . (10)
Тиомочевинный комплекс, в отличие от рассмотренных выше, является катионным. На этом основано применение тиомочевины для десорбции золота с анионообменных смол.
Соединения золота (III)
Оксид золота (III) Аи20з, темно-коричневый, нерастворимый в воде порошок, может быть получен косвенным путем из гидроксида Аи(ОН)3, который, в свою очередь, получают действием сильных щелочей на крепкий раствор НАиС14. При сушке Аи(ОН)з над пентаксидом фосфора образуется порошок состава АиО(ОН), который при осторожном нагреве до 140°С теряет воду и переходит в Аи20з. Однако уже при температуре около 160°С оксид золота (III) разлагается на элементы. Гидроксид золота (III) проявляет амфотерные свойства. Однако кислотный характер этого соединения преобладает, поэтому иногда его называют золотой кислотой. Соответствущие ей соли—аураты могут быть получены растворением Аи(ОН)3 в сильных щелочах:
Au(OH)3 + NaOH — Na [Au(OH)J.
Аураты щелочных металлов — соединения, хорошо растворимые в воде.
Соли, соответствующие основной функции Аи(ОН)3, могут быть получены растворением этого соединения в сильных кислотах, которое идет за счет образования анионных комплексов:
Из галогенидов золота (III) интересен хлорид АиС13, который получают пропусканием газообразного хлора над порошком золота при
кристаллов. В воде АиС13 растворим, водный раствор этого ■соединения имеет коричнево-красную окраску, что объясняется образованием комплексной кислоты:
Вообще, склонность к образованию комплексных анионов — характерная черта Au(III).
При добавлении к водному раствору хлорида Au (III) соляной кислоты образуется золотохлористоводородная кислота Н[АиС14]:
в результате чего раствор становится лимонно-желтым. Золотохлористоводородная кислота образуется также при растворении металлического золота в насыщенном хлором растворе соляной кислоты:
2Au + ЗС12 -f- 2НС1 = 2Hf AuClJ. (16)
При упаривании раствора золотохлористоводородная кислота кристаллизуется в виде кристаллогидрата Н[АиС14]х Х4Н20. Как сама кислота, так и многие ее соли хорошо растворимы в воде, что обусловливает их применение при аффинаже золота.
Стандартный потенциал золота (III) в хлоридных растворах достаточно высок: Au+4Cl~ = [AuCl4] _ -|-3e; ф° = = + 1,00 В. Поэтому из хлоридных растворов золото легко восстанавливается многими восстановителями: щавелевой кислотой, муравьиной кислотой, хлоридом олова (II), углеродом, оксидом углерода (II), диоксидом серы и т.д., например:
2[AuCIJ~ + ЗНгСА = 2Au + 6С02 + 8СГ + 6Н + ; (17)
4 [АиС14Г + ЗС + 6Н20 = 4Au + ЗС02 + 16СГ + 12Н + ;
2[АиС14Г + 3S02 + 6Н20 = 2Au + 3SOi~ + 8СГ + 12Н + .
Характерно, что даже перекись водорода, для которой более свойственна окислительная функция, по отношению к хлоридным растворам золота выступают в качестве восстановителя:
В практике аффинажа осаждение золота из хлоридных растворов обычно производят с помощью сульфата Fe(II).
При восстановлении из разбавленных растворов золото часто не выпадает в осадок, а образует устойчивые ярко окрашенные коллоидные растворы. Интенсивно окрашенный раствор коллоидного золота, так называемый кассиев пурпур, может быть получен восстановлением золота хлоридом олова (II):
2Н [AuCIJ + 3SnCl2 = Au + 3SnCl4 + 2HC1. (21)
Эту реакцию иногда используют для обнаружения в растворе следов золота.
В зависимости от размера и формы образующихся частиц коллоидные растворы золота имеют красный, голубой или фиолетовый цвета.
В качестве восстановителей для получения коллоидных растворов могут быть использованы гидразин, формальдегид, оксид углерода и т. д.
Из других галогенидов Au(III) представляет интерес Aul3. Это соединение, представляющее собой нерастворимый в воде порошок темно-зеленого цвета, можно получить, например, добавлением нейтрализованного раствора золотохлористводородной кислоты к раствору иодида калия:
Audi» + ЗГ = Aul3 + 4СГ. (22)
С ионами CN^ золото (III) образует комплексные анионы. Так, при действии KCN раствор АиС13 обесцвечивается вследствие образования анионов [Au(CN4)] 3_ .
Соли золота (III) кислородных кислот (серной, азотной) устойчивы лишь в концентрированных растворах соответствующих кислот. При разбавлении водой они гид-ролизуют с образованием Аи(ОН)3. В этих растворах золото, по-видимому, находится в виде комплексных анионов. Косвенно это подтверждается тем, что при упаривании раствора Аи(ОН)3 в концентрированной азотной кислоте выделяется кристаллогидрат комплексной кислоты H[Au (N03)4]-3H20. Аналогично из раствора Аи(ОН)3 в концентрированной серной кислоте упариванием с добавкой гидросульфата калия может быть выделена комплексная соль К[Аи(504)г].
Сульфид золота (III) Au2S3 представляет собой черный порошок, разлагающийся на элементы при нагревании выше 200°С. Его можно получить лишь сухим путем (например, действием сероводорода на раствор АиС13 в безводном эфире), так как действие сероводорода на соединения Au (III) в водной среде сопровождается частичным восста-
новлением золота (III). Сульфид золота (III) не растворяется в НС1 и H2SO4, но растворяется в царской водке, водном растворе цианида калия. При взаимодействии A112S3 с раствором Na2S образуется растворимый тиоаурат:
Это соединение имеет тенденцию к распаду по реакции:
NaAuS2 = NaAuS + S. Под действием воды NaAuS2 гидролизуется:
Источник: studfile.net
Целебные свойства золота и серебра

О лечебном эффекте от золотых и серебряных украшений люди знали еще давно – не в последнюю очередь из-за этого металлы так сильно ценились. К слову, они до сих пор используются в медицине. В чем же дело?
О пользе золота
Не секрет, что золотые изделия при контакте с кожей дают человеку энергетическую подпитку. Оно также имеет обеззараживающие свойства. Заметив легкий исцеляющий эффект, но не имея познаний в фармакологии, люди чуть ли не ели золото. В прямом смысле – доктора прописывали людям жевать тоненькие золотые пластинки, и добавлять в еду истертое в порошок золото. Подобным образом поступают и сейчас, только не в лечебных, а в эстетических целях.
Также раньше пили «золотую воду». В емкости кипятили воду с золотым украшением до тех пор, пока жидкость не уменьшится вдвое. Некоторые люди и сейчас так делают, но им следует помнить: в современных золотых изделиях много примесей, как и в кухонной посуде. Эти вещества могут вызвать аллергию или того хуже, возникновение некоторых болезней.
До сих пор целители советуют подержать в руках золотую вещь при упадке сил или плохом настроении. Также рекомендуют прикладывать нагретое в руках золото к больному месту. При болях в суставах – носить золотые браслеты, а если в городе появилась вирусная инфекция – золотую цепочку с кулоном.
Постоянно носить золотое украшение врачи советовали людям, склонным к печали и меланхолии.
О пользе серебра
Об антибактериальных свойствах этого металла известно давно. Пластинки серебра прикладывали к ранам еще в средние века, а состоятельные люди использовали посуду исключительно серебряную. До сих пор у многих в доме заведено есть серебряными столовыми приборами. Вплоть по изобретения антибиотиков серебряная вода была панацеей от разного типа инфекций.
Это не предрассудки. Доказано, что ионы серебра убивают бактерии брюшного тифа, дизентерии, холеры и прочих. Энергетически серебро имеет противоположный от золота эффект – оно успокаивает нервную систему.
Активно используется и до сих пор «серебряная вода». В отличие от «золотой», ее кипятить не нужно, достаточно на несколько часов окунуть серебряную вещь (высшей пробы, без эмали и камней) в воду и принимать как обычную питьевую. До сих пор продаются различные серебряные фигурки для этих целей.
Кстати, секрет священности реки Ганг, которая течет в Индии, как раз в залежах серебра на дне. Именно поэтому ее воды обладают лечебным эффектом, который заметили еще несколько тысячелетий назад.
В современной медицине
Ультратонкие золотые нити вживляются под кожу для стимуляции выработка коллагена, что не только делает кожу упругой, но и позволяет ей оставаться такой долгое время. В наименьших дозах золото входит в состав лекарств против аутоиммунных заболеваний.
Существует такое понятие как «коллоидное серебро». Это раствор, содержащий определенную концентрацию частичек серебра. Попадая в организм, они действуют как антисептик. Используется как альтернатива антибиотикам, оказывая противомикробное и противовоспалительное действие.
Ионы серебра используются не только в медицине, а даже в стиральных машинках для обеззараживания белья.
Риски
Переизбыток даже самого ценного металла на свете губительно действует на организм.
Хоть золото и инертный металл, некоторые его соединения могут быть токсичны, от них в большей степени страдает печень.
Что касается серебра, то не стоит забывать: это – тяжелый металл, его накопление в организме несет вред. Не зря же работа в серебряных копях крайне опасна.
Может также случиться и отравление серебром – агригоз. Это неизлечимая, но не очень опасная болезнь. Главный ее симптом – синевато-серая, порой серебристая кожа. Такое изменение необратимо.
Источник: zot.moscow