Виды гибридизации электронных облаков
Гибридизация АО – это выравнивание валентных АО по форме и энергии в процессе образования химической связи .
1. В гибридизации могут участвовать только те АО, энергия которых достаточно близка (например, 2s- и 2р-атомные орбитали).
2. В гибридизации могут участвовать вакантные (свободные) АО, орбитали с неспаренными электронами и неподеленными электронными парами.
3. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов электронные пары оказались максимально удаленными друг от друга. Такое состояние молекулы отвечает минимуму энергии в силу максимального отталкивания одноименно заряженных электронов.
4. Вид гибридизации (число АО, подвергающихся гибридизации), определяется числом «атакующих» данный атом атомов и числом неподеленных электронных пар в данном атоме.
Например, в молекуле аммиака NH3 атом азота «атакуют» 3 атома водорода, кроме того, атом азота имеет 1 неподеленную пару электронов. В связи с этим число гибридных АО у атома азота равно (3 + 1) = 4, соответственно вид гибридизации – sp 3 .
Гибридизация атомных орбиталей и геометрия молекул. 10 класс.
АО, не имеющие электронов в основном состоянии атома либо ставшие вакантными при перераспределении электронов в процессе образования молекулы, могут не участвовать в гибридизации, если для них не хватает «атакующих» атомов (для образования s-связей). Такие АО частично или полностью включаются в образование p-связей.
Например, атом С может быть в состоянии sp-, sp 2 — и sp 3 -гибридизации.
1. sp-гибридизация. Такой вид гибридизации характерен для атомов элементов 2-ой группы периодической системы в молекулах типа ЭХ2 (например, в молекулах галогенидов бериллия, цинка, кадмия и ртути), а также для атома С в молекулах алкинов (при тройной связи), карбина, СО2.
Пример. ВеF2. В момент образования связи происходит перестройка АО атома Ве, переходящего в возбужденное состояние: Ве 1s 2 2s 2 ® Ве* 1s 2 2s 1 2p 1 .
Гибридные АО располагаются под углом 180 о . Благодаря такому виду гибридизации обе связи являются одинаковыми и молекула имеет линейное строение: F–Be–F.
2. sp 2 -гибридизация. Такой вид гибридизации характерен для атомов элементов 3-ей группы периодической системы в молекулах типа ЭХ3 (например, в соединениях бора – галогенидах, борной кислоте, триметилборе), а также для атома С в графите, молекулах алкенов, алкадиенов (при двойных связях), бензола.
Пример. ВF3. В момент образования связи происходит перестройка АО атома В, переходящего в возбужденное состояние: В 1s 2 2s 2 2p 1 ® B* 1s 2 2s 1 2p 2 .
Гибридные АО располагаются под углом 120 о . Молекула имеет форму правильного треугольника (плоская, треугольная):
3. sp 3 -гибридизация. Такой вид гибридизации характерен для атомов 4-ой группы (например, углерода, кремния, германия) в молекулах типа ЭХ4, а также для атома С в алмазе, молекулах алканов, для атома N в молекуле NH3, NH4 + , атома О в молекуле Н2О и т.д.
Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталей
Пример 1. СН4. В момент образования связи происходит перестройка АО атома С, переходящего в возбужденное состояние: С 1s 2 2s 2 2p 2 ® С* 1s 2 2s 1 2p 3 .
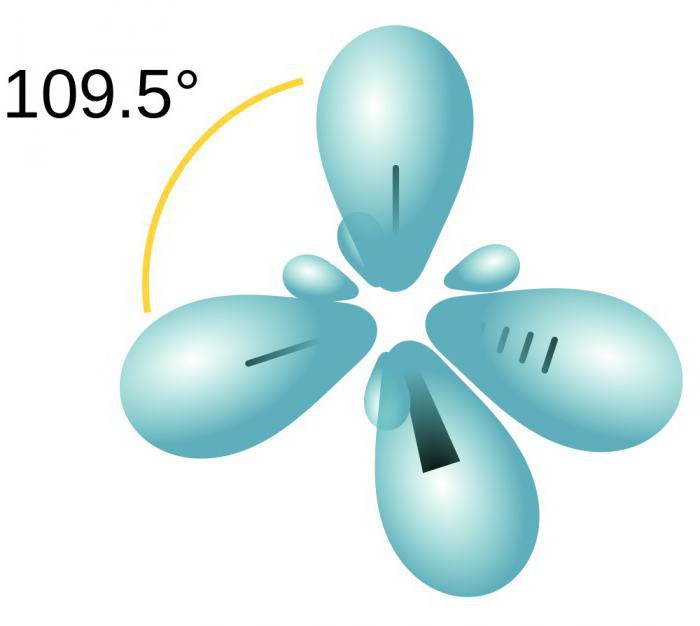
Гибридные АО располагаются под углом 109 о 28′.
Молекула имеет форму тетраэдра:
Электронная структура атома N: 1s 2 2s 2 2p 3 . Гибридизации подвергаются 3 АО, содержащие неспаренные электроны, и 1 АО, содержащая неподеленную электронную пару. В силу более сильного отталкивания неподеленной электронной пары от электронных пар s-связей угол связи в молекуле аммиака составляет 107,3 о (ближе к тетраэдрическому, а не к прямому).
Молекула имеет форму тригональной пирамиды:
Представления об sp 3 -гибридизации позволяют объяснить возможность образования иона аммония и равноценность связей в нем.
Электронная структура атома О 1s 2 2s 2 2p 4 . Гибридизации подвергаются 2 АО, содержащие неспаренные электроны, и 2 АО, содержащие неподеленные электронные пары. Угол связи в молекуле воды составляет 104,5 о (также ближе к тетраэдрическому, а не к прямому).
Молекула имеет угловую форму:
Представления об sp 3 -гибридизации позволяют объяснить возможность образования иона оксония (гидроксония) и образование каждой молекулой 4-х водородных связей в структуре льда.
4. sp 3 d-гибридизация. Такой вид гибридизации характерен для атомов элементов 5-ой группы (начиная с Р) в молекулах типа ЭХ5.
Пример. РСl5. Электронная структура атома Р в основном и возбужденном состояниях: Р 1s 2 2s 2 2p 6 3s 2 3p 3 ® P* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 1 . Форма молекулы – гексаэдр (точнее – тригональная бипирамида):
5. sp 3 d 2 -гибридизация. Такой вид гибридизации характерен для атомов элементов 6-ой группы (начиная с S) в молекулах типа ЭХ6.
Пример. SF6. Электронная структура атома S в основном и возбужденном состояниях: S 1s 2 2s 2 2p 6 3s 2 3p 4 ® P* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 2 .
Форма молекулы – октаэдр:
6. sp 3 d 3 -гибридизация. Такой вид гибридизации характерен для атомов элементов 7 группы (начиная с Cl) в молекулах типа ЭХ7.
Пример. IF7. Электронная структура атома F в основном и возбужденном состояниях: I 5s 2 3p 5 ® I* 5s 1 3p 3 3d 3 . Форма молекулы – декаэдр (точнее – пентагональная бипирамида):
7. sp 3 d 4 -гибридизация. Такой вид гибридизации характерен для атомов элементов 8 группы (кроме Не и Ne) в молекулах типа ЭХ8.
Пример. ХеF8. Электронная структура атома Хе в основном и возбужденном состояниях: Хе 5s 2 3p 6 ® Хе* 5s 1 3p 3 3d 4 .
Форма молекулы – додекаэдр:
Могут быть и другие виды гибридизации АО.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Гибридизация орбиталей и структура комплексов

Применяя обычный алгоритм предсказания типа гибридизации атомных орбиталей в рамках метода валентных связей, можно определить геометрию комплексов разного состава. Для этого прежде всего необходимо написать электронную формулу валентного уровня и построить схему распределения электронов по квантовым ячейкам. Например, для нейтрального атома никеля: [Ar] 3d 8 4s 2 4p 0
Переход 4s-электронов на 3d-подуровень превращает парамагнитный атом Ni 0 в диамагнитную частицу Ni*: [Ar] 3d 10 4s 0 4p 0
Полученные вакантные орбитали подвергаются гибридизации, образуя тетраэдрическую конфигурацию. Так построен тетраэдрический диамагнитный комплекс тетракарбонилникель [Ni(CO)4] (КЧ = 4), который характеризуется значительной устойчивостью.
Если комплексообразователем служит никель(II) с электронной конфигурацией [Ar]3d 8 4s 0 4p 0 , то надобность в перемещении электронов с 4s-подуровня перед гибридизацией отпадает, так как для реализации координационного числа 4 имеется достаточное число вакантных орбиталей:
Такое строение имеет неустойчивый парамагнитный комплекс тетрабромоникколат(II)-ион [NiBr4] 2- . Однако при объединении двух электронов 3d-подуровня в пару и превращении одной из квантовых ячеек этого подуровня в вакантную меняется и тип гибридизации, и характеристика получаемого комплекса:
Тип гибридизации dsp 2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона [Ni(CN)4] 2- (КЧ = 4):
Если синтез цианидного комплекса вести в условиях избытка лиганда, можно реализовать координационное число 5 sp 3 d(х 2 -у 2 ):
Устойчивый диамагнитный комплекс пентацианоникколат(II)-ион [Ni(CN)5] 3- имеет форму квадратной пирамиды:

Октаэдрический комплекс никеля(II) [Ni(H2O)6] 2+ , хотя и парамагнитен, но достаточно устойчив. Его образование обусловлено sp 3 d 2 -гибридизацией атомных орбиталей никеля:
Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым. Строение таких комплексов может отвечать типу гибридизации nsp 3 d 2 . Например: [СоF6] 3- (4sp 3 d 2 ).
Такие комплексы, при образовании которых имеет место гибридизация с участием атомных орбиталей предвнешнего d-подуровня, называются внутриорбитальными или низкоспиновыми и, как правило диамагнитны или слабо парамагнитны (все или почти все электроны комплексообразователя спарены, а тип гибридизации, например, 3d 2 4sp 3 или 3d4sp 2 .
Так, при рассмотрении комплексов железа(II) обнаруживаются и внешнеорбитальные, и внутриорбитальные комплексы:
В парамагнитном, высокоспиновом, внешнеорбитальном гексафтороферрат(II)-ионе [FeF6] -4 тип гибридизации 4sp 3 d 2 . В диамагнитном, низкоспиновом, внутриорбитальные гексацианоферрат(II)-ионе [Fe(CN)6] -4 — 3d 2 4sp 3 .
Сама по себе теория валентных связей не дает однозначного ответа на вопрос, какой вид комплекса образуется в каждом конкретном случае, так как этот метод не учитывает влияния природы лиганда. Чаще в конкретном случае зная состав можно предположить несколько типов гибридизации и пространственного строения комплексной частицы.
Поэтому метод валентных связей должен обязательно дополняться данными о магнитных свойствах комплекса либо сведениями о влиянии лиганда на характер образующегося комплекса. Так, для вышеупомянутых комплексов [NiBr4] 2- , [Ni(CO)4] и [Ni(CN)4] 2- выбор dsp 2 и sp 3 типами гибридизации можно сделать на основании данных об их магнитных свойствах. А для диамагнитного комплекса [Ni(CN)5] 3- возможны два типа гибридизации и пространственного строения: sp 3 d(х 2 -у 2 ) (квадратная пирамида) и sp 3 d(z 2 ) (триганальная бипирамида). Выбор между двумя вариантами можно сделать в результате изучения пространственного строения комплекса методом рентено-структурного анализа.
Метод рентгено-структурного анализа основан на изучении диффракции рентгеновского излучения на атомах кристаллов веществ позволяет определить пространственное расположение атомов в кристалле.
Источник: megaobuchalka.ru
Поговорим о том, как определить тип гибридизации
Поговорим о том, как определить тип гибридизации, а также рассмотрим геометрическое строение молекулы.
История появления термина
В начале двадцатого века Л. Полинглом была предложена теория геометрии молекул с ковалентной связью. В качестве основы для образования связи было взято перекрывание электронных облаков. Метод стали называть валентными связями. Как определять тип гибридизации атомов в соединениях? Автор теории предлагал учитывать смешивание гибридных орбиталей.
Определение
Для того чтобы понять, как определить тип гибридизации в соединениях, разберем, что обозначает этот термин.
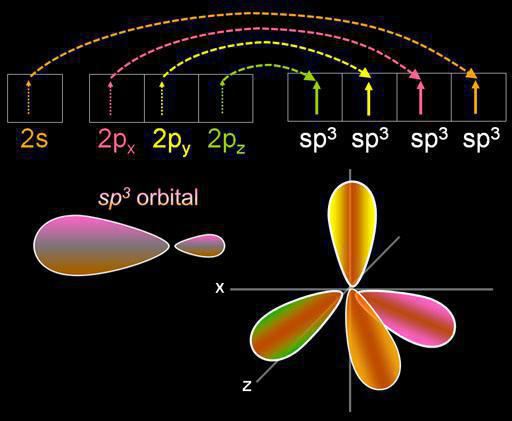
Гибридизация представляет собой смешивание электронных орбиталей. Данный процесс сопровождается распределением в них энергии, изменением их формы. В зависимости от того, в каком количестве будут смешиваться s- и p-орбитали, тип гибридизации может быть различным. В органических соединениях атом углерода может существовать в состоянии sp, sp2, sp3. Есть и более сложные формы, в которых участвуют, помимо sp, d-орбитали.
Правила выявления в молекулах неорганических веществ
Выявить вариант гибридизации можно для соединений с ковалентной химической связью, имеющих тип АВп. А – основной атом, В – лиганд, п – число от двух и выше. В подобной ситуации в гибридизацию будут вступать только валентные орбитали главного атома.
Способы определения
Поговорим подробнее о том, как определить тип гибридизации. В химическом понимании данный термин предполагает изменение энергии и формы орбиталей. Наблюдается подобный процесс в тех случаях, когда для образования связи используют электроны, которые принадлежат различным типам.
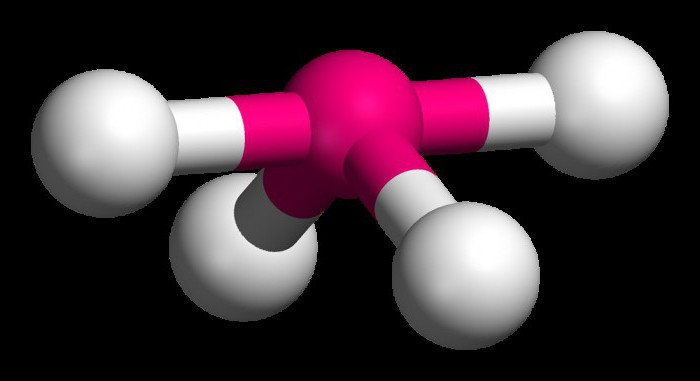
Чтобы понять, как определить тип гибридизации, рассмотрим молекулу метана. Данное вещество является первым представителем гомологического ряда насыщенных (предельных) углеводородов. В пространстве молекула СН4 является тетраэдром. Единственный атом углерода образует с водородами связи, сходные по энергии и длине. Для того чтобы образовались такие гибридные облака, используются три р- и один эс-электрон.
Четыре облака смешиваются, и возникает четыре одинаковых (гибридных) вида, имеющих форму неправильной восьмерки. Называют такой тип гибридизации sp3. Все углеводороды, в составе которых только простые (одинарные) связи, характеризуются именно таким типом гибридизации атома углерода. Валентный угол составляет 109 градусов 28 минут.
Продолжим разговор о том, как определить тип гибридизации. Примеры ненасыщенных углеводородов ряда этилена дают представление о sp2-гибридизации. Например, в молекуле этилена из четырех валентных электронов в образовании химической связи используется только три. Оставшийся негибридный р-электрон уходит на образование двойной связи.
Ацетилен является простейшим представителем класса СпН2п-2. Особенностью этого класса углеводородов является наличие тройной связи. Из четырех валентных электронов углеродного атома только два меняют свою форму и энергию, становясь гибридными. Два оставшихся электрона принимают участие в образовании двух двойных связей, определяя ненасыщенный характер этого класса органических соединений.
Заключение
Рассматривая вопрос, касающийся ковалентной химической связи для органических и для неорганических веществ, учитывают гибридизацию атомных орбиталей. При этом происходит выравнивание их энергии и формы. Электрон, располагающийся вблизи ядра связанного атома, характеризуется совокупностью орбиталей, которые обладают одинаковым квантовым числом. Информация о типе гибридизации дает возможность оценивать химические свойства вещества.
Источник: fb.ru