Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
6. Теоретические основы в химии Читать 0 мин.
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
8. Виды химической связи.
Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная неполярная связь
Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.
Рассмотри образование ковалентной неполярной связи, на примере водорода:
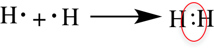
Ковалентная полярная связь
Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
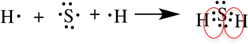
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из отдает свои электроны и он заряжется положительно. Элемент, который принимает электроны заряжается отрицательно.
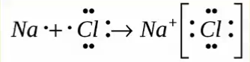
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C 2 H 5 OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН 3 ОСН 3 , не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С 2 Н 6 О).
Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 класс
Тип связи
Примеры
Cl 2 , O 2 , Br 2 , I 2 , N 2 и др.
HCl, H 2 S, HBr, H 2 O, SO 2 , SO 3 и др.
Источник: reshutest.ru
Виды химической связи золото
Ключевые слова конспекта: Металлическая химическая связь: ион-атомы и электронный газ. Физические свойства металлов и их применение на основе этих свойств. Чёрные и цветные металлы. Сплавы.
Подавляющее число химических элементов периодической системы Д. И. Менделеева относятся к металлам:
- все s-элементы, кроме водорода и гелия;
- все d-элементы;
- p-элементы IIIА-группы, кроме бора;
- некоторые p-элементы IVA- (олово и свинец) и VA- (сурьма и висмут) групп, а также p-элемент VIIА-группы — полоний.
Анализ положения металлов в периодической системе и учёт особенностей строения их атомов позволяет сделать следующие выводы: атомы этих элементов содержат небольшое число электронов на внешнем слое (1—3), имеют сравнительно большой радиус атома и много свободных орбиталей, которые могут легко перекрываться. Поэтому валентные электроны свободно перемещаются от одних атомов, превращая их в ионы, к другим, связывая их.
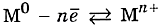
В простых веществах-металлах осуществляется бесконечный процесс превращения атомов в ионы и обратно, который можно отразить с помощью схемы:
Эти же процессы происходят и в металлических сплавах.
| Связь в металлах и сплавах между ион–атомами, осуществляемая совокупностью валентных электронов, называется металлической связью . |
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены ион–атомы. Обобществлённые подвижные электроны не принадлежат какому–то определённому атому и способны перемещаться по всему объёму металла.
В отсутствие в нём электрического поля эти электроны хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решётки. В 1900 г. немецкий физик Пауль Друде предложил называть совокупность этих электронов электронным газом. Этот электронный газ прочно соединяет, как бы склеивает ионный остов металла. При механических нагрузках или нагреве газ не допускает разрыва металлической решётки, связывая положительные ионы. Поэтому при обработке металлов изменение их формы происходит без разрушения кристаллической решётки, так как её слои легко скользят один по другому.
Металлы электропроводны, потому что под действием электрического поля валентные электроны начинают направленное движение — возникает электрический ток. Металлы — это проводники первого рода, в отличие от растворов электролитов, которые относятся к проводникам второго рода.