Химики доказали, что, вопреки распространенному мнению, замена дорогостоящих благородных металлов, используемых для ускорения химических реакций, на дешевые аналоги может увеличить, а не уменьшить стоимость конечного продукта. Это заключение позволит избежать безосновательного отказа от эффективных платиновых катализаторов, с помощью которых синтезируют большинство лекарств и многие полимеры.
Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Organometallics. При создании большинства медицинских препаратов, а также «умных» полимеров, применяемых, например, для доставки лекарств, химики часто используют катализаторы, содержащие благородные металлы платиновой группы. Помимо платины, к ним относятся рутений, родий, палладий, осмий и иридий. Однако в последнее время ученые пытаются заменить их на более распространенные и дешевые аналоги, например, марганец, кобальт и никель.
Необходимость такой замены часто объясняют тем, что мировые запасы благородных металлов ограничены, к тому же их стоимость высока. Однако при внимательном анализе эти опасения оказываются сильно преувеличенными. Риск истощения ресурсов благородных металлов в ближайшие 100 лет незначителен, особенно по сравнению с перспективой исчерпания запасов доступной нефти. Кроме того, в синтезе, помимо благородных металлов, используются и другие вещества, поэтому не факт, что цена зависит именно от металла.
Инвестиции в золото, серебро и цветные металлы.
Ученые из Института элементоорганических соединений имени А. Н. Несмеянова РАН (Москва) проанализировали вклад различных компонентов, используемых в химическом синтезе, в стоимость получаемого продукта. Для этого авторы сравнили затраты на проведение шести различных химических реакций, в которых из одинаковых исходных веществ образуется одно и то же соединение — изохинолон. Эта органическая молекула входит в состав ряда флуоресцентных материалов и биологически активных молекул, а потому представляет интерес для молекулярной биологии, химии и медицины.
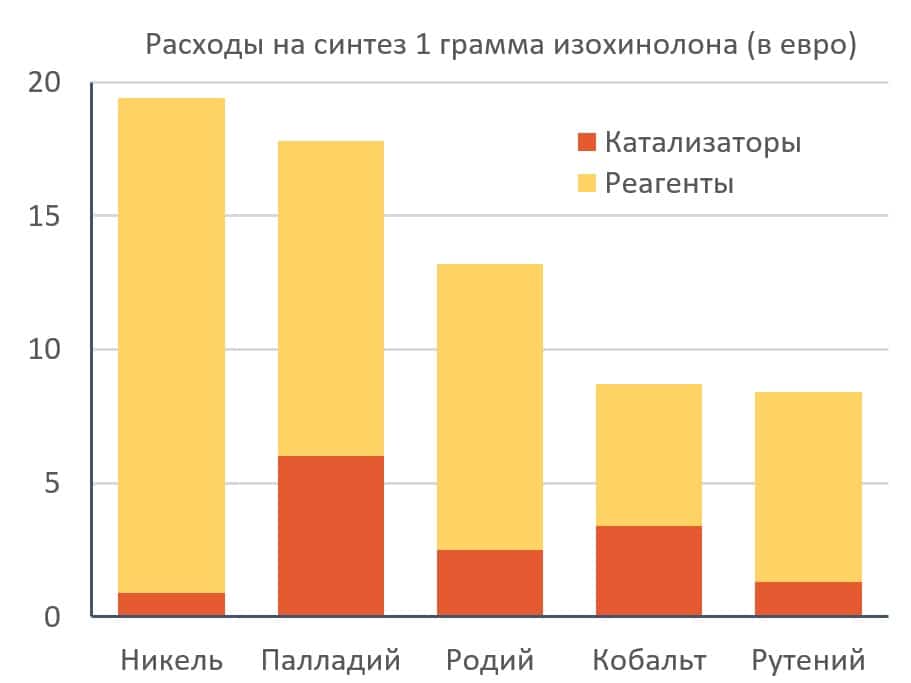
Три из исследованных реакций требуют участия катализаторов на основе благородных металлов — палладия, родия и рутения. Еще две протекают в присутствии более дешевых никеля и кобальта, и оставшаяся — без использования металлов. При расчете стоимости каждого превращения авторы учитывали цену исходных реагентов, металлов, а также лигандов — своего рода добавок, входящих в состав катализаторов.
Анализ показал, что превращение, в котором используется родий, всего на 50 процентов дороже того, в котором требуется катализатор на основе кобальта. При этом металлический родий примерно в 8000 раз дороже, чем металлический кобальт. В химическом синтезе столь значительная разница в цене становится практически незаметной потому, что металлы используются в малых количествах (порядка одного процента от массы всех используемых веществ). В результате, согласно расчетам, цена на исходные металлы составляет всего 10–30 процентов от общей стоимости реакции, а основные затраты (70–90 процентов) оказались связаны с органическими реагентами. Это означает, что даже полная замена дорогостоящих благородных металлов на дешевые аналоги будет незначительно влиять на себестоимость процесса.
Благородные металлы, свойства. Noble metals
Интересно, что использование катализаторов на основе дешевых металлов может даже непреднамеренно увеличить цену производства, если при этом увеличится расход других — более дорогих — реагентов. Такая ситуация, в первую очередь, может возникнуть на заключительных стадиях синтеза сложных лекарственных молекул, поскольку себестоимость реагентов уже высока за счет того, что для их получения потребовалось нескольких предшествующих реакций.
«Результаты анализа показывают, что стоимость химического превращения зависит в первую очередь от органических реагентов, а не катализаторов. Поэтому некорректно аргументировать отказ от использования благородных металлов в составе катализаторов лишь их дороговизной. Наша работа подчеркивает, что ученые должны реалистично оценивать разные факторы для достижения максимальной эффективности. В дальнейшем мы планируем проверить наши выводы на более широком круге химических реакций», — рассказывает участник проекта, поддержанного грантом РНФ, Дмитрий Перекалин, доктор химических наук, заведующий лабораторией функциональных элементоорганических соединений Института элементоорганических соединений имени А. Н. Несмеянова РАН.
Источник: naked-science.ru
Общие сведения о благородных металлах и рудах
Благородные металлы отличаются от других элементов, известных еще древним народам, неизменяемостью на воздухе, трудностью добычи и высокой стоимостью. Теперь их также называют драгоценными; хотя некоторые тугоплавкие элементы пока дороже золота и платины.
Золото и серебро были известны задолго до начала нашей эры. Египтяне разрабатывали золотоносные россыпи в Нубии (Восточная Африка). Финикийцы там же открыли богатую золотом страну Офир, они знали о многих месторождениях золота и серебра в Армении, Испании и на Кипре.
Первые достоверные сведения о древней металлургии благородных металлов имеют давность, соизмеримую с историей древней Греции — 40–50 вв. до н. э.
Первым применением золота (Au) и серебра (Ag) было изготовление украшений и утвари, а с развитием обмена – монеты. До конца прошлого века, а кое-где и поныне, эти металлы во многих странах служили денежным материалом, а затем приобрели функцию фондового эквивалента банкнот.
В 1738 г. испанский математик Дон Антоние де Уллоа во время путешествия в Южную Америку обнаружил платину (Pt) – «белое золото», считавшуюся сначала сплавом золота и серебра. В литературе XVIII в. ее называли «гнилым» или «лягушечьим» золотом, ценили в два раза ниже серебра и иногда для фальсификации добавляли в золотую монету. Только в 1752 г., после исследований Шеффера, платина была признана новым элементом.
В 1803 г. Волластон, обрабатывая самородную платину царской водкой, обнаружил в растворе два других благородных металла – палладий (Pd) и родий (Rh). Вскоре (1803 – 1804 гг.) Смитсон Теннант в нерастворимом остатке от подобной обработки платины нашел осмий (Os) и иридий (Ir). Рутений (Ru) открыл в 1844 г. К. К. Клаус в уральских месторождениях платины и назвал его в честь России Rhutenia (лат.).
Интересно отметить происхождение названий других платиноидов: платина соответствует испанскому plata – серебро, родий – греческому родос, отмечающему розовый цвет растворов. Палладий назван в честь открытия астероида Паллада, а иридий происходит от греческого ирис, принятого из-за различия окраски ионов.
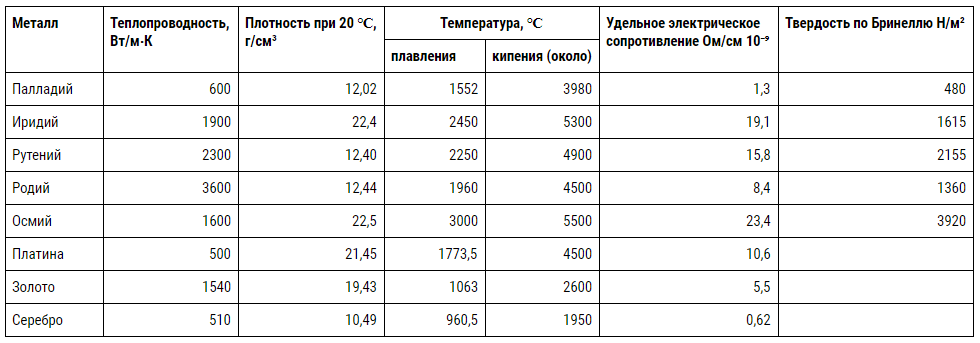
Некоторые физические и механические свойства платиноидов собраны в табл. 23, знакомясь с которой следует обратить внимание на высокие температуры плавления металлов и их твердость, близкую, например, у иридия, осмия и рутения к закаленной стали. Вместе с тем золоту и платине свойственны мягкость, ковкость и тягучесть. О химических свойствах сказано ниже.
С развитием промышленности благородные металлы находили все более широкое техническое применение.
Современное значение благородных металлов
Золото, продолжая оставаться денежным эквивалентом, входит во многие сплавы с серебром, платиной, медью, никелем, оловом, в том числе применяемые за рубежом при монтаже реактивных двигателей, ракет и ядерных реакторов. Чистый металл с его высокой отражательной способностью и коррозионной стойкостью может служить прекрасным покрытием, хорошо отражающим свет. Известно, что первые американские спутники покрывали слоем золота толщиной в несколько тысячных или сотых долей микрометра. Использование металла для зубных протезов постепенно сокращается: для этого разработано несколько заменяющих сплавов; однако они пока еще остаются менее привлекательными.
Серебро вошло в область промышленного использования после изобретения фотографии, а далее также в связи с широким распространением кинематографии, рентгенографии, производства щелочных аккумуляторов и ядерной энергии. Спрос промышленности на него давно уже превышает выплавку, и этот дефицит стараются пополнять вторичными металлами, перерабатывая старую монету, зеркальный бой, ювелирные изделия и использованные фото-киноматериалы.
Платину долго не умели очищать от примесей, понижающих ее ковкость. В 70-х годах XVIII в. впервые были получены технические изделия из чистого металла: пластины, тигли, проволока; они ценились из-за стойкости против концентрированных сильных кислот. В начале XIX в. стали делать платиновые сосуды для получения серной кислоты массой более 10 кг.
Вместе с тем до середины того же столетия в некоторых странах из платины чеканили монету и делали украшения. После второй мировой войны потребление ее в ювелирном деле и медицине, составлявшее ранее около 60 % общего производства, сократилось до 8–10 %. Наряду с этим сильно возрос спрос на платиноиды, как на заменители платины. В виде сетки, губки, проволоки, жести и в мелко раздробленном состоянии платина, палладий и сплавы платины с палладием, родием, иридием, рутением, а также сплавы платины и палладия с неблагородными металлами служат катализаторами в неорганической и органической технологии. Их применяют при синтезе аммиака из азота и водорода, для гидрогенизации и дегидрогенизации органических веществ, восстановления нитросоединений и галогенидов, в производстве серной и синильной кислот.
В нефтяной промышленности катализаторы из платиновых металлов необходимы для производства высокооктанового топлива и ряда синтетических продуктов. При гидрировании некоторых органических соединений применяют осмий. Палладий служит также для очистки водорода и дейтерия.
В электротехнике, электронике и приборостроении платина, платиноиды и разные их сплавы употребляются при монтаже аппаратуры связи, для деталей астрономических приборов и электродов рентгеновских трубок. Термопары из платины и ее сплавов с родием пригодны для длительного измерения высоких температур; возможные пределы этого расширяются с увеличением процента родия в сплавах, который менее летуч. Покрытия родием, имеющим высокую отражательную способность, важны для прожекторной техники, они не теряют свойств до 400 °С. Весьма твердые сплавы осмия с иридием идут на изготовление точных измерительных инструментов – астрономических и мореходных. Замена платины платиноидами часто выгодна: палладий и рутений дешевле платины.
Иридий приблизительно в пять раз дороже золота; поэтому применение его в чистом виде пока мало. Тигли из этого металла пригодны для опытов при температурах до 2300 °С. Весьма стойки электролитические и химические покрытия иридием металлов и керамики толщиной менее 0,1 мм. Радиоактивный изотоп Ir 192 с периодом полураспада 74,5 суток, получаемый в атомных реакторах, служит для гамма-дефектоскопии и датчиком уровня сыпучих материалов.
Осмий также очень дорог – по крайней мере, в 30 раз дороже золота. В некоторых реакциях гидронизации органических веществ он оказывает более сильное каталитическое действие, чем платина. Несмотря на высокую стоимость, из соединений осмия делают особую черную краску для росписи фарфора.
Свойства благородных металлов
Несмотря на разнообразие свойств, благородные металлы обнаруживают и некоторое сходство. Прежде всего все они переходные элементы V и VI периодов, где расположены последовательными рядами с №44 по 47 и с №76 по 79. По размещению в группах Периодической системы рутений и осмий сходны с железом, палладий и платина – с никелем, родий и иридий – с кобальтом, а золото и серебро – с медью.
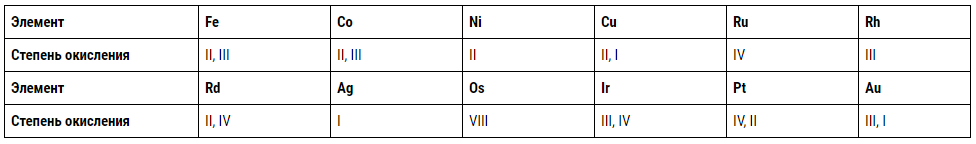
Структура атомов переходных элементов различается зарядом ядра, числом d-электронов и внешних s-электронов. Последние имеют сравнительно малое значение из-за преимущественного образования благородными металлами комплексных соединений и малого числа простых солей. По мере заполнения d-орбиталей наиболее типичная степень окисления, показанная ниже римскими цифрами, понижается, а с увеличением порядкового номера в группах она возрастает:
Осмий окисляется кислородом воздуха при обычных температурах до OsO4, а иридий, рутений и палладий только в тонко диспергированном виде и достаточно быстро лишь при нагревании.
Другие благородные металлы не окисляются даже чистым кислородом. Оксиды: Ag2O, Au2O3, Rh2O3, Ir2O3, PtO2 и др. можно получить только косвенным путем — преобразованием иных химических соединений этих элементов.
Серебро и палладий растворяются в азотной кислоте. Золото и платина окисляются царской водкой, которая на иридий, родий и рутений действует лишь весьма медленно, палладий она также переводит в раствор, а серебро – в твердый хлорид. На осмий и рутений царская водка совсем не действует.
Родий окисляется концентрированной, горячей серной кислотой, образуя сульфат Rh2(SO4)3, он также реагирует с расплавами кислых сульфатов натрия и калия.
Осмии и рутений переводят в растворы сплавлением с оксидами натрия (II) либо бария (IV) (Na2O2, BaO2) или плавкой со щелочью и окислителем, например, с NaOH и NaClO3. Сплавы или спеки растворяются в воде.
Рутений(II), родий (III) и палладий (II) образуют простые ионы только в растворах перхлоратов, а серебро также в растворах сульфатов, нитратов, ацетатов и некоторых других. Прочие благородные металлы образуют в водных растворах лишь комплексные катионы и анионы, окислительно-восстановительные свойства которых в значительной мере зависят от прочности связи с лигандом. Часто встречаемые в литературе потенциалы простых ионов благородных металлов получены расчетом и не всегда имеют реальный физический смысл; хотя и могут быть использованы в качестве термодинамических констант.
Источник: metallurgist.pro
3. Свойства и применение благородных металлов и сплавов
Согласно Федеральному закону от 26.03.1998 № 41-ФЗ «О драгоценных металлах и драгоценных камнях» к драгоценным (благородным) металлам, используемым для изготовления ювелирных изделий, относят золото, серебро, платину и пять металлов платиновой группы: палладий, иридий, родий, рутений, осмий.
Золото (Au) — металл желтого цвета, с сильным блеском, пластичный (один грамм золота может вытягиваться в нить длиной до трех километров); обладает значительной механической прочностью, химически устойчив к большинству кислот и щелочей. Золото растворяется только в царской водке (смеси HNO3 и HCl в соотношении 1:3). С кислородом воздуха золото непосредственно не соединяется. Плотность – 19,32 г/см 3 , температура плавления – 1064 °С. Золото — очень мягкий металл, его твердость по шкале Мооса составляет 2,5.
В природе главным образом встречается самородное золото (растворы серебра в золоте с примесями меди, железа и других металлов) и значительно реже – химические соединения золота с теллуром и селеном. Самородное золото имеет вид кристаллов, чешуек, пластинок или волокон, а также зерен и кусков массой до 40 кг.
Золотую руду чаще всего добывают из золотосодержащего серного колчедана в жильных месторождениях, а также в рассеянных вкраплениях в массе различных горных пород. Нередко золото находят в серебряно-свинцовых и кварцевых рудах. Извлекают золото из руд методами цианирования, амальгамирования, а также при пирометаллургической обработке руд цветных металлов.
Цианирование – способ извлечения золота из руд путем их растворения в слабых растворах цианистых натрия и калия. Это наиболее распространенный способ обработки золотых руд. Амальгамация – способ извлечения золота из руд при помощи ртути. При смачивании ртутью золото образует амальгаму и в таком виде отделяется от породы.
При пирометаллургической обработке руд цветных металлов содержащееся в них золото дает сплав с извлекаемым металлом. В дальнейшем с помощью электролитического рафинирования золото выделяют в виде шламов. Последующая переработка шламов позволяет получить золото в чистом виде. Используется как основной компонент сплавов и в качестве покрытия.
Аффинаж драгоценных металлов – процесс очистки извлеченных драгоценных металлов от примесей и сопутствующих компонентов, доведение их до качества, соответствующего национальным стандартам и техническим условиям.
Серебро (Ag) – белый, блестящий, очень ковкий и тягучий металл; обладает наивысшей отражающей способностью (94 %), хороший проводник электричества и тепла, пластичный – прокатывается в тонкие листы толщиной до 0,00025 мм и вытягивается в тончайшую проволоку. Серебро чернеет при наличии в воздухе или воде сероводорода. Плотность – 10,49 г/см 3 , температура плавления — 960,5 °С.
Твердость по шкале Мооса – 2,7. Серебро имеет высокую химическую устойчивость – растворяется только в крепкой азотной и подогретой серной кислотах. В природе серебро встречается в самородном виде, а также входит в состав свинцово-цинковых руд. Используется как основной компонент сплавов и припоев для ювелирных изделий и в качестве покрытия.
Платина (Pt) — серебристо-белый ковкий металл, не растворим в кислотах (кроме нагретой царской водки); имеет высокую плотность – 21,45 г/см 3 и температуру плавления 1772 °С. Твердость по шкале Мооса – 4,2. В природе платина встречается в самородном состоянии. Используется как основной компонент платиновых сплавов, обычно в изделиях с бриллиантами.
Палладий (Pd) – металл серебристо-белого цвета, в природе встречается вместе с платиной; ковкий, тягучий, хорошо прокатывается в тонкие листы и проволоку. Плотность – 12,02 гс/м 3 , температура плавления – 1552 °С. Твердость по шкале Мооса – 4,8. Растворяется в азотной кислоте, смеси азотной и соляной кислот.
Использование палладия в качестве легирующего металла в сплаве золото-палладий ввело новый термин – «белое золото», что подчеркивает обесцвечивающую (по отношению к золоту) способность палладия. Палладий используется для изготовления ювелирных украшений как компонент высокотемпературных припоев.
Иридий (Ir) – металл белого цвета, с серым оттенком, очень твердый, но хрупкий. Химически стойкий — на него не действуют кислоты и щелочи. Имеет очень высокие показатели плотности (22,42 г/см 3 ) и температуры плавления (2450 °С). Твердость по шкале Мооса – 6,5. При накаливании докрасна иридий обладает некоторой ковкостью; обработка его вследствие высокой твердости затруднена.
Используется в платиновых сплавах вместе с родием в качестве легирующего компонента. Добавка иридия к платине значительно увеличивает ее твердость.
Родий (Rh) – хрупкий металл бледно-голубого цвета, по внешнему виду похож на алюминий; растворяется в концентрированной серной кислоте. Смесь азотной и соляной кислот (царская водка) на родий не действует. Благодаря высокой отражающей способности (коэффициент отражения – 75–80 %) применяется для покрытия металлов, в т.ч. серебра и изделий из «белого золота». Плотность – 12,42 г/см 3 , температура плавления – 1960 °С. Твердость по шкале Мооса – 6,5.
Рутений (Ru) – серебристо-белый металл, по внешнему виду похож на платину, но более твердый и хрупкий. Плотность – 12,37 г/см 3 , температура плавления – 2950 °С. Применяется как компонент платиновых сплавов. Получают рутений при переработке и очистке сырой платины после того, как на предыдущих операциях аффинажа из раствора были удалены платина, иридий, палладий, родий и осмий.
Осмий (Os) – белый, с серо-голубым оттенком металл, тугоплавкий (температура плавления самая высокая из металлов платиновой группы – 3047 °С); тяжелый, плотность – 22,48 г/см 3 ; твердый (7,5); хрупкий. Осмий обладает высокой химической устойчивостью, не поддается механической обработке, добавляется в платиновые сплавы для придания им твердости и упругости.
Чистые драгоценные металлы являются либо сравнительно мягкими и недостаточно износостойкими (особенно золото и серебро) либо хрупкими (как иридий или осмий). Кроме того, при определенных видах ювелирных работ они не обладают необходимой технологичностью. Наконец, драгоценные металлы сравнительно дороги.
Сплавы драгоценных металлов
При производстве ювелирных изделий, как правило, используют различные сплавы, получаемые путем добавления к драгоценным металлам в определенных пропорциях других металлов, называемых легирующими. Легирующими могут быть как драгоценные, так и недрагоценные металлы, но полученные сплавы всегда считаются драгоценными. Обычно название сплава определяется названием основного драгоценного (благородного) металла (например, сплав золота, серебра, платины или палладия).
Основная характеристика каждого сплава – его состав или проба. В РФ используется метрическая проба — количество частей драгоценного металла, измеренное в долях на тысячу единиц массы сплава.
В России для ювелирных и других бытовых изделий из драгоценных металлов установлены следующие пробы:
- платиновые: 950, 900, 850;
- золотые: 999, 958, 750, 585, 500, 375;
- серебряные: 999, 960, 925, 875, 830, 800;
- палладиевые: 850 и 500.
Источник: studfile.net