Диамагнетики — вещества, намагничивающиеся против направления внешнего магнитного поля и имеют отрицательную магнитную восприимчивость. В присутствии внутреннего магнитного поля диамагнетики магнитны.
Парамагнетики — вещества, которые намагничиваются во внешнем магнитном поле в направлении внешнего магнитного поля и имеют положительную магнитную восприимчивость, но значительно меньшую единицы.
Ферромагнетики — вещества, которые (при температуре ниже точки Кюри) способны обладать намагниченностью в отсутствие внешнего магнитного поля.
Антиферромагнетики — вещества, в которых установился антиферромагнитный порядок магнитных моментов атомов или ионов. В антиферромагнетиках спиновые магнитные моменты электронов самопроизвольно ориентированы антипараллельно друг другу. Такая ориентация охватывает попарно соседние атомы. В результате антиферромагнетики обладают очень малой магнитной восприимчивостью и ведут себя как слабые парамагнетики.
Ферримагнетики — вещества, у которых магнитные моменты атомов различных подрешёток ориентируются антипараллельно, как и в антиферромагнетиках, но моменты различных подрешёток не равны, и, тем самым, результирующий момент не равен нулю. Ферримагнетики характеризуются спонтанной намагниченностью.
3 8 Диамагнетики, парамагнетики, ферромагнетики
Гелимагнетики — вещества со спиральными структурами, у которых расположение спинов характеризуется винтовой симметрией (с характерным углом поворота где-то между 0 и 180 градусами).
Таблица диамагнетиков, парамагнетиков, ферромагнетиков (1 часть):
Магнитный тип
Источник: chemicalstudy.ru
Диамагнитные, парамагнитные и ферромагнитные вещества. Магнитная проницаемость и магнитная индукция
Все вещества, помещенные в магнитное поле, приобретают магнитные свойства, т.е. намагничиваются и поэтому изменяют внешнее поле. При этом одни вещества ослабляют внешнее поле, а другие усиливают его. Первые называются диамагнитными, вторые – парамагнитными веществами. Среди парамагнетиков резко выделяется группа веществ, вызывающих очень большое усиление внешнего поля. Это ферромагнетики.
Диамагнетики — фосфор, сера, золото, серебро, медь, вода, органические соединения.
Парамагнетики — кислород, азот, алюминий, вольфрам, платина, щелочные и щелочноземельные металлы.
Ферромагнетики – железо, никель, кобальт, их сплавы.
Геометрическая сумма орбитальных и спиновых магнитных моментов электронов и собственного магнитного момента ядра образует магнитный момент атома (молекулы) вещества.
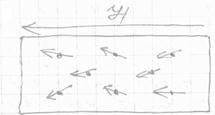
У диамагнетиков суммарный магнитный момент атома (молекулы) равен нулю, т.к. магнитные моменты компенсируют друг друга. Однако под влиянием внешнего магнитного поля у этих атомов индуцируется магнитный момент, направленный противоположно внешнему полю. В результате диамагнитная среда намагничивается и создает собственное магнитное поле, направленное противоположно внешнему и ослабляющее его.
Диамагнетики и парамагнетики

Индуцированные магнитные моменты атомов диамагнетика сохраняются до тех пор, пока существует внешнее магнитное поле. При ликвидации внешнего поля индуцированные магнитные моменты атомов исчезают и диамагнетик размагничивается.
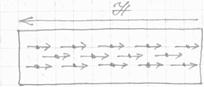
У атомов парамагнетиков орбитальные, спиновые, ядерные моменты не компенсируют друг друга. Однако атомные магнитные моменты расположены беспорядочно, поэтому парамагнитная среда не обнаруживает магнитных свойств. Внешнее поле поворачивает атомы парамагнетика так, что их магнитные моменты устанавливаются преимущественно в направлении поля. В результате парамагнетик намагничивается и создает собственное магнитное поле, совпадающее с внешним и усиливающим его.
При ликвидации внешнего поля под действием теплового движения ориентация магнитных моментов атома нарушается и парамагнетик размагничивается.

Результирующая напряженность магнитного поля в веществе H’ равна
Где -напряженность поля, создаваемого самой средой. Знак (+) берется для парамагнетиков, (-) для диамагнетиков. Поскольку ~H, то
Где -магнитная проницаемость среды, которая характеризует ее способность намагничиваться под влиянием внешнего поля.
Магнитное поле в веществе принято характеризовать индукцией магнитного поля
где 0-магнитная постоянная. Или (4), где
-абсолютная магнитная проницаемость среды.
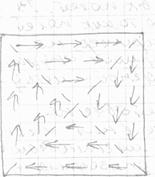
В ферромагнетиках имеются области (~10 -2 см) с одинаково ориентированными магнитными моментами их атомов. Однако ориентация самих доменов разнообразна. Поэтому в отсутствие внешнего магнитного поля ферромагнетик не намагничен.
С появлением внешнего поля домена, ориентированные в направлении этого поля, начинают увеличиваться в объеме за счет соседних доменов, имеющих иные ориентации магнитного момента; ферромагнетик намагничивается. При достаточно сильном поле все домены переориентируются вдоль поля и ферромагнетик быстро намагничивается до насыщения.

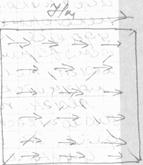
При ликвидации внешнего поля ферромагнетик полностью не размагничивается, а сохраняет остаточную магнитную индукцию, так как тепловое движение может разориентировать домены. Размагничивание может быть достигнуто нагреванием, встряхиванием или приложением обратного поля.
При температуре равной точке Кюри, тепловое движение оказывается способным дезориентировать атомы в доменах, вследствие чего ферромагнетик превращается в парамагнетик.
Поток магнитной индукции через некоторую поверхность S равен числу линий индукции, пронизывающих эту поверхность:
Единица измерение B –Тесла, Ф-Вебер.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Золото это диамагнетик или парамагнетик
Все атомы так или иначе реагируют на магнитные поля, но реагируют по-разному в зависимости от конфигурации атомов, окружающих ядро. В зависимости от этой конфигурации элемент может быть диамагнитным, парамагнитным или ферромагнитным. Диамагнитные элементы, которые в некоторой степени фактически являются всеми ими, слабо отталкиваются магнитным полем, тогда как парамагнитные элементы слабо притягиваются и могут намагничиваться. Ферромагнитные материалы также обладают способностью намагничиваться, но в отличие от парамагнитных элементов, намагниченность является постоянной. И парамагнетизм, и ферромагнетизм сильнее, чем диамагнетизм, поэтому элементы, которые проявляют либо парамагнетизм, либо ферромагнетизм, больше не являются диамагнитами.
Только несколько элементов являются ферромагнитными при комнатной температуре. Они включают железо (Fe), никель (Ni), кобальт (Co), гадолиний (Gd) и, как недавно обнаружили ученые, рутений (Ru). Вы можете сделать постоянный магнит с любым из этих металлов, подвергая его воздействию магнитного поля. Список парамагнитных атомов намного длиннее.
Парамагнитный элемент становится магнитным в присутствии магнитного поля, но он теряет свои магнитные свойства, как только вы удаляете поле. Причиной такого поведения является наличие одного или нескольких неспаренных электронов во внешней орбитальной оболочке.
Парамагнитные и диамагнитные элементы
Одним из наиболее важных открытий в науке за последние 200 лет является взаимосвязь электричества и магнетизма. Поскольку у каждого атома есть облако отрицательно заряженных электронов, у него есть потенциал для магнитных свойств, но от того, будет ли он отображать ферромагнетизм, парамагнетизм или диамагнетизм, зависит их конфигурация. Чтобы оценить это, необходимо понять, как электроны решают, какие орбиты занять вокруг ядра.
У электронов есть качество, называемое вращением, которое вы можете визуализировать как направление вращения, хотя оно более сложное, чем это. Электроны могут иметь «раскрутку» (которую вы можете визуализировать как вращение по часовой стрелке) или «раскрутку» (против часовой стрелки).
Они располагаются на растущих, строго определенных расстояниях от ядра, называемого оболочками, и внутри каждой оболочки находятся подоболочки с дискретным числом орбиталей, которые могут быть заняты максимум двумя электронами, каждый из которых имеет противоположный спин. Два электрона, занимающие орбиталь, называются парными. Их вращения отменяются, и они не создают чистого магнитного момента. С другой стороны, один электрон, занимающий орбиталь, является неспаренным, и это приводит к суммарному магнитному моменту.
Диамагнитные элементы — это те, у которых нет неспаренных электронов. Эти элементы слабо противодействуют магнитному полю, которое ученые часто демонстрируют, левитируя диамагнитный материал, такой как пиролитический графит или лягушка (да, лягушка!), Над сильным электромагнитом. Парамагнитные элементы — это те, которые имеют неспаренные электроны. Они дают атому чистый магнитный дипольный момент, и когда поле приложено, атомы выравниваются с полем, и элемент становится магнитным. Когда вы удаляете поле, тепловая энергия вмешивается, чтобы рандомизировать выравнивание, и магнетизм теряется.
Вычисление того, является ли элемент парамагнитным или диамагнитным
Электроны заполняют оболочки вокруг ядра таким образом, чтобы минимизировать чистую энергию. Ученые обнаружили три правила, которым они следуют при этом, известные как принцип Ауфбрау, правило Хунда и принцип исключения Паули. Применяя эти правила, химики могут определить, сколько электронов занимает каждая из оболочек, окружающих ядро.
Чтобы определить, является ли элемент диамагнитным или парамагнитным, необходимо только посмотреть на валентные электроны, которые занимают самую внешнюю подоболочку. Если внешняя подоболочка содержит орбитали с неспаренными электронами, элемент является парамагнитным. В противном случае это диамагнит. Ученые идентифицируют подоболочки как s, p, d и f. При написании конфигурации электронов принято, что валентные электроны должны предшествовать благородному газу, который предшествует рассматриваемому элементу в периодической таблице. Благородные газы имеют полностью заполненные электронные орбитали, поэтому они инертны.
Например, электронная конфигурация для магния (Mg) составляет [Ne] 3s2. Внешняя подоболочка содержит два электрона, но они непарные, поэтому магний является парамагнитным. С другой стороны, электронная конфигурация цинка (Zn) имеет вид [Ar] 4s23d10. В его внешней оболочке нет неспаренных электронов, поэтому цинк является диамагнитным.
Список парамагнитных атомов
Вы можете рассчитать магнитные свойства каждого элемента, записав их электронные конфигурации, но, к счастью, вам это не нужно. Химики уже создали таблицу парамагнитных элементов. Они заключаются в следующем:
Литий (Li)
Кислород (O)
Натрий (Na)
Магний (Mg)
Алюминий (Al)
Калий (К)
Кальций (Ca)
Скандий (Sc)
Титан (Ti)
Ванадий (V)
Марганец (Mn)
Рубидий (Rb)
Стронций (Sr)
Иттрий (Y)
Цирконий (Zr)
Ниобий (Nb)
Молибден (Мб)
Технеций (Tc)
Рутений (Ru) (недавно обнаружен ферромагнитный)
Родий (Rh)
Палладий (Pd)
Цезий (Cs)
Барий (Ба)
Лантан (Ла)
Церий (Ce)
Празеодим (Pr)
Неодим (Nd)
Самарий (см)
Европий (ЕС)
Тербий (Tb)
Диспрозий (Dy)
Гольмий (Хо)
Эрбий (Er)
Тулия (тм)
Иттербий (Yb)
Лютеция (Лу)
Гафний (Hf)
Тантал (Та)
Вольфрам (W)
Рений (Ре)
Осмий (Os)
Иридий (Ir)
Платина (Pt)
Торий (Th)
Протактиний (Па)
Уран (U)
Плутоний (Пу)
Америций (A)
Парамагнитные Соединения
Когда атомы объединяются, образуя соединения, некоторые из этих соединений могут также проявлять парамагнетизм по той же причине, что и элементы. Если на орбиталях соединения существует один или несколько неспаренных электронов, соединение будет парамагнитным. Примеры включают молекулярный кислород (O2), оксид железа (FeO) и оксид азота (NO).
В случае с кислородом этот парамагнетизм можно отобразить с помощью сильного электромагнита. Если вы наливаете жидкий кислород между полюсами такого магнита, кислород будет накапливаться вокруг полюсов, поскольку он испаряется, создавая облако газообразного кислорода. Попробуйте тот же эксперимент с жидким азотом (N2), который не является парамагнитным, и такое облако не образуется.
Если вы хотите составить список парамагнитных соединений, вам придется изучить электронные конфигурации. Поскольку именно неспаренные электроны во внешних валентных оболочках придают парамагнитные качества, соединения с такими электронами могли бы составить список. Хотя это не всегда так. В случае молекулы кислорода существует четное число валентных электронов, но каждый из них занимает более низкое энергетическое состояние, чтобы минимизировать общее энергетическое состояние молекулы. Вместо пары электронов на более высокой орбитали, есть два неспаренных электрона на более низких орбиталях, что делает молекулу парамагнитной.
Источник: www.winstein.org