Тест — таблица для проверки знаний по теме «Азотная кислота».
Скачать:
Предварительный просмотр:
9 класс. Азотная кислота.
1. Степень окисления в азотной кислоте у азота равна:
2. Азотная кислота в растворе не реагирует с веществом, формула которого:
3. С обоими веществами, какой пары может реагировать азотная кислота:
аммиак и гидроксид меди (II)
гидроксид натрия и нитрит железа (II)
карбонат кальция и оксид углерода (IV)
медь и оксид серы (VI)
карбонат калия и платина
4. Сумма коэффициентов в уравнении реакции:
Hg +HNO 3 → Hg (NO 3 ) 2 +NO 2 +H 2 O равна:
5. Азотная кислота — это
Тяжелая маслянистая жидкость
Твердое бесцветное кристаллическое вещество
Бесцветная дымящаяся жидкость
6. Азотная кислота без изменения степени окисления вступает в реакции с
7. Азотной кислоте соответствует оксид
8. Концентрированная азотная кислота вступает в реакцию с
9. При попадании на кожу концентрированной азотной кислоты появляются пятна
10. Соли азотной кислоты
9 класс. Азотная кислота.
1. Степень окисления в азотной кислоте у азота равна:
2. Азотная кислота в растворе не реагирует с веществом, формула которого:
3. С обоими веществами, какой пары может реагировать азотная кислота:
гидроксид натрия и нитрит железа (II)
аммиак и гидроксид меди (II)
карбонат кальция и оксид углерода (IV)
медь и оксид серы (VI)
карбонат калия и платина
4. Сумма коэффициентов в уравнении реакции:
Hg +HNO 3 → Hg (NO 3 ) 2 +NO 2 +H 2 O равна:
5. Азотная кислота — это
Тяжелая маслянистая жидкость
Твердое бесцветное кристаллическое вещество
Бесцветная дымящаяся жидкость
6. Азотная кислота без изменения степени окисления вступает в реакции с
7. Азотной кислоте соответствует оксид
8. Концентрированная азотная кислота вступает в реакцию с
9. При попадании на кожу концентрированной азотной кислоты появляются пятна
10. Соли азотной кислоты
По теме: методические разработки, презентации и конспекты

урок в 9 классе Азотная кислота
Клочкова Виолетта Михайловна, учитель химии МБОУ СОШ № 2 имени И. И. Тарасенко ст. Выселки Краснодарского края.

Урок химии 9 класс по теме Азотная кислота
Клочкова Виолетта Михайловна, учитель химии МБОУ СОШ № 2 имени И. И. Тарасенко ст. Выселки Краснодарского края.

Урок химии в 9 классе по теме «Кислородные соединения азота. Азотная кислота»
Урок изучения новой темы с презентацией.
приложение к уроку «Азотная кислота: состав молекулы, физические и химические свойства». «Азотная кислота: состав молекулы, физические и хими- ческие свойства». Приложение к уроку «Азотная кислота:
Приложение к уроку, заполняемое учащимися в учебное портфолио.
ЭТО ЗОЛОТО с СЕРЕБРОМ! ОРАЛ Я на ВЕСЬ ЛЕС!!! ПОИСК ЗЛАТА СЕРЕБРА с КОНСТАНТИНОМ!

«Азотная кислота и её соли. Окислительные свойства азотной кислоты».
Технологическая карта урока по теме позволяет реализовать данный урок в более свободной форме.

Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты.
Методическая разработка урока по химии в 9 классе «Соли азотной кислоты». УМК Г.Е. Рудзитис, Ф.Г. Фельдман. Химия.
9 класс. М.: Просвещение, 2019
Структура урока включает в себя следующие этапы: Организационный этап, приветствие и проверка готовности к уроку, психологического настроя учащихся.Проверка домашнего задания. Выполн.
Источник: nsportal.ru
Газообразное золото XXI века: как добывают деньги из воздуха

В воздухе есть компоненты, которые присутствуют в нем практически в неизменном количестве постоянно, в любое время суток и года, на всех континентах. Именно они делают воздух воздухом и являются наиболее ценным ресурсом для промышленности, медицины и современных технологий. Поделитесь этой новостью Воздушные компоненты можно разделить на две группы.
Первая — азот, кислород и аргон — занимают 99,9% воздушного объема. На вторую группу приходится лишь оставшаяся десятая доля процента. Это редчайшие вещества — неон, криптон и ксенон. В атмосфере все эти газы перемешаны, как ингредиенты в коктейле. Чтобы получить каждый из них в чистом виде, транспортировать, хранить и использовать, то есть в прямом смысле добывать деньги из воздуха, нужны особые технологии и оборудование.

Криогенными считаются технологии, работающие в условиях ниже минус 150 градусов по Цельсию. Иметь дело с такими температурами не просто сложно, а архисложно. Разделение воздуха происходит при температурах, которых не существует в земной природе. На Северном полюсе зимой в среднем только минус 40 градусов.
А в самой холодной точке планеты столбики термометров лишь изредка опускаются ниже минус 80. В криогенных установках температура нужна минимум на 100 градусов ниже.

Атмосферный воздух закачивают в прямом смысле с улицы. Затем его сжимают и удаляют все вредные примеси. Далее воздух охлаждают и направляют на разделение в ректификационные колонны, на выходе из которых получают чистые компоненты, технические газы — азот, аргон и кислород.

Чистота кислорода должна составлять не менее 99,5%. Его использую и металлургические заводы, и больницы. По сути, кислород — такой же медицинский препарат, как и лекарства. Поэтому и требования к нему высокие. Криогенную жидкость медицинского назначения заливают в автоцистерны и перед отправкой машины снова проверяют.
Превращение кислорода из газа в жидкость — это сложный технологический процесс с множеством нюансов и тонкостей. В текучем состоянии этот газ ни в металлургии, ни в медицине не используют. Жидкость — это только удобная форма хранения и транспортировки. В сжиженном виде кислород в 860 раз компактнее, чем в своей естественном газообразном состоянии.
Кислород — важная, но не единственная полезная составляющая воздуха. Два его атмосферных спутника — азот и аргон — имеют не меньшее значение в промышленности. Аргон металлурги используют как своеобразный газовый миксер. С помощью него перемешивают расплав, вышедший из печи.
Незаменим этот газ при сварочных работах, особенно когда соединить нужно такие сложные металлы, как медь, алюминий или титан. Аргон в процессе сварки создает вокруг электродуги защитный слой, вытесняет оттуда воздух. Иначе шов сделать не получится, металлы просто сгорят.
Источник: cont.ws
Газообразные вещества

Соединение, находящееся в одном из основных агрегатных состояний, при котором составные частицы слабо связаны между собой, называется газом или газообразным веществом. Частицы газа движутся хаотично и в некоторых случаях могут переходить в жидкое и твёрдое состояния.
Получение
Существуют вещества, которые при нормальных условиях сохраняются в газообразном агрегатном состоянии. Их можно разделить на две группы:
- простые – азот, кислород, хлор;
- сложные – аммиак, метан, углекислый газ.
Газы выделяют из атмосферы или природного газа путём окисления и адсорбции примесей.
Образованию газообразного состояния веществ способствует изменение нормальных условий. Жидкие или твёрдые вещества нагревают, тем самым разрушая химические связи и высвобождая отдельные молекулы в воздух. Например, жидкая вода при нагревании легко превращается в водяной пар, а твёрдый йод выделяет фиолетовые пары.

В лабораториях газ получают путём разложения (сжигания) сложных веществ или реакцией жидких и твёрдых соединений. Способы получения некоторых газов:
Zn + 2HCl = ZnCl2 + H2↑;
2KMnO4 = K2MnO4 + MnO2 + О2↑;
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑;
NH4Cl + NaOH = NaCl + H2O + NH3↑.
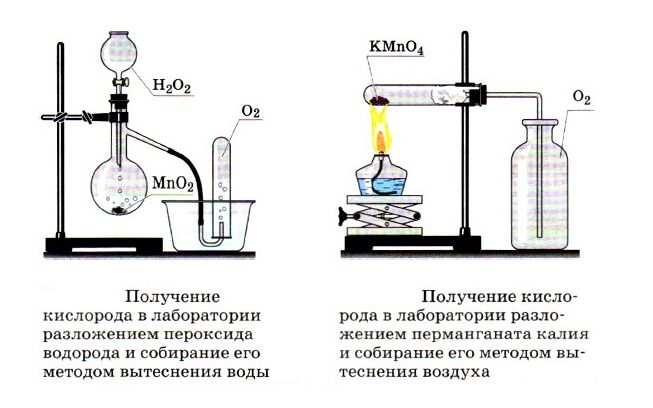
Полученный газ обнаруживают разными способами. Например, пропускают через жидкость и наблюдают за изменением цвета, прозрачности (известковое молочко мутнеет в присутствии углекислого газа). Некоторые газы поддерживают горение или, наоборот, тушат тлеющую лучину.
Физические свойства
Молекулы газообразного вещества постоянно движутся, а расстояние между ними значительно превышает их диаметр. Благодаря такому расположению частиц газы не имеют формы, легко смешиваются и сжимаются.
Газообразные соединения приобретают форму сосуда, в котором находятся. Ударяясь о стенки сосуда с определённой скоростью, газы создают давление. Чем интенсивнее молекулы воздействуют на сосуд, тем выше давление.
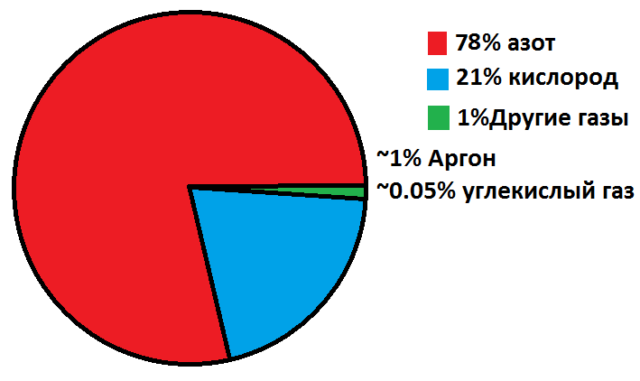
Различные газообразные соединения смешиваются между собой в любых пропорциях. Природный газ – это смесь метана, водорода, сероводорода, углекислого газа, азота, гелия. Атмосфера состоит из смесей простых и сложных газообразных веществ – азота, кислорода, водорода, углекислого газа, водяного пара.
При сжатии объём газов становится значительно меньше. Например, объём кислорода уменьшается в 200 раз.
Описание некоторых газообразных веществ представлено в таблице.
Формула
Физические свойства
Нахождение в природе
Самый лёгкий газ, легче воздуха в 14,5 раз. Не имеет вкуса, запаха, цвета. Плохо растворяется в воде (18,8 мл/100 г), но хорошо растворяется в металлах, особенно в палладии. Сжижается при -252,76°C
В земной коре – 1 %, незначительное количество в атмосфере. Большая часть водорода присутствует в виде соединений
Не имеет вкуса, цвета, запаха. Немного тяжелее воздуха. Плохо растворяется в воде (4,9 мл/100 г) и спирте (2,78 мл/100 г), но хорошо растворяется в жидком серебре. Сжижается при -182,98°C
47 % земной коры состоит из кислорода. Моря и пресные водоёмы содержат 85 % кислорода. В атмосфере – 20 %
Бесцветный газ без запаха. Плохо растворим в воде (2,3 мл/100 г). Атомы азота связаны тройной трудно разрываемой связью. Сжижается при -195,8°C
В атмосфере – 78 %. Один из наиболее распространённых элементов, найденных за пределами Земли. Входит в состав белков
Жёлто-зелёный газ с запахом. Легко сжижается уже при -34°C. При давлении в 0,8 МПа и комнатной температуре становится жидким. Плохо растворяется в воде (1,48 мл/100 г), хорошо растворяется в бензоле и хлороформе
Наиболее распространённый галоген. В природе встречается только в составе минералов
Бесцветный газ, не имеющий запаха при малых концентрациях. В большом количестве имеет кислый запах. В 1,5 раза тяжелее воздуха. Кристаллизуется при -78,3°С. Жидкое состояние получают при комнатной температуре и давлении в 6 МПа
В атмосфере содержится меньше 1 %
Бесцветный газ с резким запахом. В два раза тяжелее воздуха. Хорошо растворяется в воде
Образуется путём разложения азотсодержащих веществ
За счёт свободного движения молекул газ равномерно распространяется в ограниченном пространстве. Такое явление называется диффузией. Яркий пример диффузии – распространение запахов. При приготовлении пищи на кухне запах постепенно распространяется по всей квартире.
Что мы узнали?
Газ – вещество, состоящее из хаотично движущихся частиц – молекул или атомов. Газообразные соединения можно получить выделением из атмосферы путём адсорбции и окисления. Также газ получают из жидких и твёрдых веществ путём изменения условий или взаимодействием простых и сложных веществ.
Газы не имеют формы, легко смешиваются между собой и равномерно распределяются в закрытом пространстве. Наиболее распространённый газ в атмосфере – азот. Самый лёгкий газ.
Источник: obrazovaka.ru