В периодической системе Д. И. Менделеева золото находится в одной группе с серебром и медью, но его химические свойства гораздо ближе к химическим свойствам металлов пла тиновой группы. Электродный потенциал пары Au равен 1,5 В. Как благородный металл зо лото химически мало активно. На воздухе оно не претерпевает изменений.
Природное золото в нормальных условиях инертно по отношению к большинству органических и неорганиче ских веществ. Золото не растворяется в щелочах и органических кислотах, в большинстве минераль ных (серной, соляной, азотной, плавиковой) кислот, за исключением горячей селеновой кис лоты H2SeO4. Золото растворяется в хлорной воде и в аэрируемых растворах цианидов щелочных ме таллов. Ртуть растворяет золото. Ювелирные изделия в процессе эксплуатации не подвержены воздействию агрессивных коррозионных сред, и практически сплавы 585-й пробы или более высокой пробы не вызыва ют проблем связанных с коррозией.
Физико-механические свойства золота
Золото – ярко-желтый блестящий металл. При нагревании слитка из чистого золота происходит процесс окисления и золото принимает красноватый оттенок – или, как раньше говорили, червонный. Золото имеет гцк решетку и не претерпевает аллотропических превращений вплоть до температуры плавления (1063С). Плотность золота равняется 19,32 г/см3.
Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.
Теплопроводность золота () при 20С составляет 420 Вт/(м•град) и мало меняется с повышением температуры. Золото имеет высокую отражательную способность, хорошо полируется и обладает вы сокой пластичностью (относительное удлинение =30-50 %, сужение площади поперечного сечения =90 %) – прокатывается в листы толщиной до 0,0001 мм. Один грамм Au можно вытянуть в виде проволоки на длину в 3,5 км, расплющить до толщины 0,000127 мм.
В состав золотых сплавов в качестве легирующих компонентов могут входить: серебро, медь, никель, палладий, платина, цинк и кадмий. Каждый из компонентов по-своему влияет на свойство сплава. Серебро придает золотому сплаву мягкость и ковкость, понижает температуру плавле ния и изменяет цвет золота.
С увеличением содержания серебра цвет сплавов изменяется от желтого к светлому. Сплавы золото-серебро хорошо поддаются механической обработке и представляют со бой непрерывный ряд твердых растворов этих металлов друг в друге. Легирование золота се ребром оказывает по сравнению с другими легирующими элементами наименьшее влияние на прочностные характеристики золотых сплавов.
Медь повышает твердость золотого сплава, сохраняя ковкость и тягучесть. При повыше нии содержания меди сплав постепенно приобретает красноватые оттенки и при содержании 14,6 % Cu становится ярко-красным. Недостатки легирования медью заключаются в том, что медь понижает антикоррозионные свойства сплава и при большом ее содержании поверх ность сплава темнеет.
Никель и золото обладают неограниченной растворимостью в жидком, а при высоких температурах и в твердом состоянии. Сплавы системы золото – никель имеют гцк решетку. Легирование золота никелем приводит к повышению твердости. Никель хорошо растворяет ся в меди, в серебре практически нерастворим.
Как проверить золото при помощи йода
Палладий и золото обладают неограниченной взаимной растворимостью в жидком и твердом состоянии. Палладий повышает температуру плавления золотого сплава и резко изменяет его цвет – при содержании в сплаве 10 % палладия слиток окрашивается в белый цвет. Золото с добавками палладия (белое золото) превосходит по своим свойствам сплавы золота с никелем и является более благородным. Платина окрашивает золото в белый цвет интенсивнее палладия, желтизна теряется.
Среди двухкомпонентных сплавов золота в ювелирной промышленности встречаются сплавы системы золото – медь и золото – серебро. В ювелирной промышленности для изготовления золотых изделий используют в большинстве случаев трехкомпонентные сплавы системы золото–серебро–медь, которые мо гут содержать добавки других металлов: никеля, палладия, цинка, платины.
Сплавы 958-й пробы – трехкомпонентные сплавы. Сплав считается высокопробным, имеет приятный ярко-желтый цвет, близкий к цвету чистого золота. Сплавы золота этой про бы термически не упрочняются и являются очень мягкими, в результате чего полировка на изделиях из сплавов 958-й пробы держится недолго. Сплавы золота 958-й пробы имеют наи более высокую химическую стойкость.
Сплавы 917-й пробы мягкие, пластичные, легко подвергаемые вальцеванию имеют не большое распространение. Сплавы 750-й пробы – трехкомпонентные и более, кроме золота в составе сплавов этой пробы может быть серебро, медь, палладий и цинк. Сплавы 750-й пробы химически устойчи вы против действия сильных кислот.
Сплавы золота 585-й и родственной ей 583-й пробы обладают хорошими технологиче скими свойствами, хорошей паяемостью, имеют красивый внешний вид, высокие антикорро зионные и механические свойства. По химической стойкости они относятся к группе раство римых в минеральных кислотах сплавов. Сплавы золота низких проб. Сплавы 375-й и 333-й пробы принято считать низкопроб ными.
Цвета сплавов красноватые, приглушенные. Сплавы золота 375-й пробы относятся к тускнеющим на воздухе сплавам, что ограничивает их применение в ювелирном произ водстве. При потере полировки изделие приобретает сероватую тональность.
Дата добавления: 2015-09-04 ; просмотров: 2412 . Нарушение авторских прав
Картограммы и картодиаграммы Картограммы и картодиаграммы применяются для изображения географической характеристики изучаемых явлений.
Источник: studopedia.info
Презентация на тему Золото. Свойство золота
Свойства химическая устойчивость, инертность удельный вес 19,3 г/см3 большая плотность возможность лёгкой обработки и изготовление украшений и культурных ценностей из золота, блеск, бесконечная пластичность. Золото стоит на 77 месте
Слайды и текст этой презентации
Слайд 1Золото
Выполнил: ст.гр.2162 Кубеев Н.А.

Слайд 2Свойства
химическая устойчивость, инертность
удельный вес 19,3 г/см3
большая плотность
возможность
лёгкой обработки и изготовление украшений и культурных
ценностей из золота,
блеск,
бесконечная пластичность.
Золото стоит на 77 месте по распространенности элементов в земной коре.

Слайд 3Применение
Изделия из золота
и слитки на сегодняшний день выступают в
роли важнейших объектов инвестирования денежных средств. Применение золота не ограничено сферой инвестиций. Металл используется в производстве ювелирных украшений, при реализации современных технологий в самых разных отраслях промышленности, а также в медицине.

Слайд 4Запасы
Данные по запасам золота в разных источниках
весьма разнятся, зависит от выбираемого критерия. В
таблице данные по детально изученным запасам. В действительности золота в недрах больше.

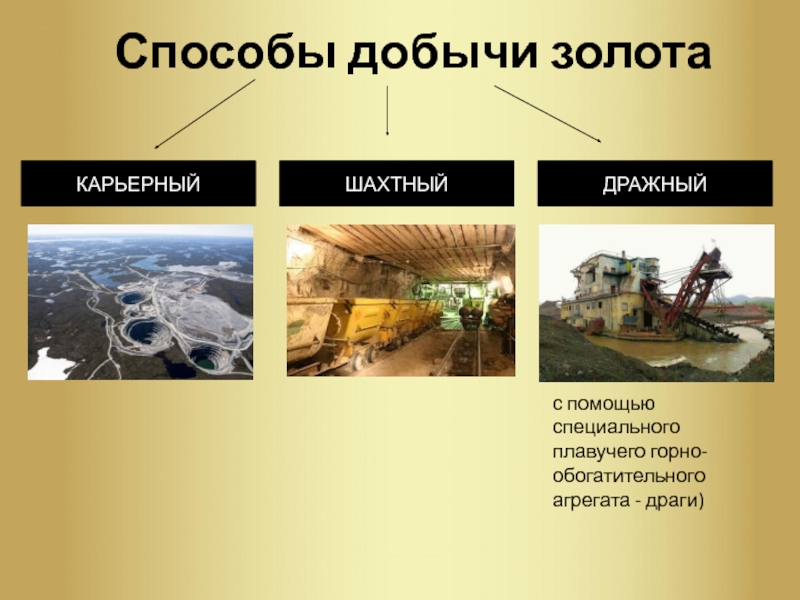
Слайд 5Способы добычи золота
ШАХТНЫЙ
ДРАЖНЫЙ
КАРЬЕРНЫЙ
с помощью специального плавучего
горно-обогатительного агрегата — драги)
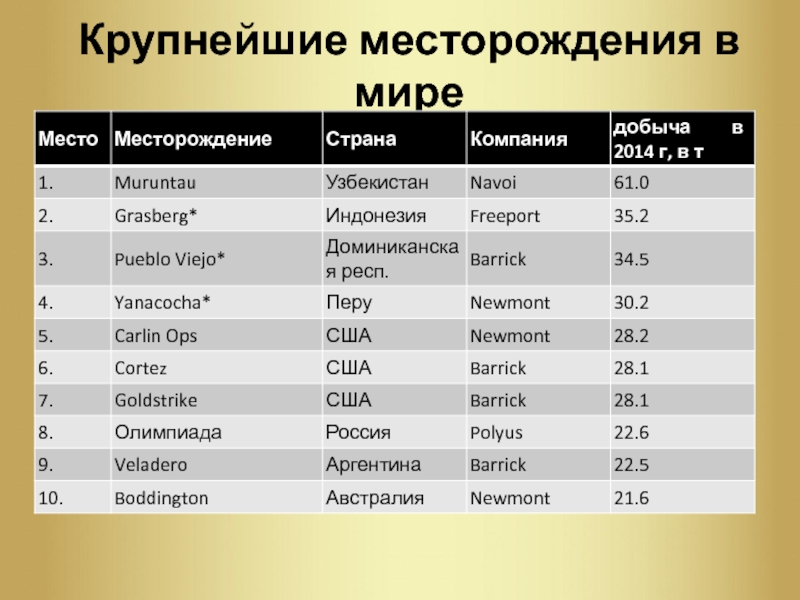
Слайд 6Крупнейшие месторождения в мире
Мурунтау,
Узбекистан — огpoмный открытый кaрьер, по оценкам
yченыx, здесь запаса золота еще около 170 млн унций, так что при нынешнем уровне добычи рудник может быть лидером в течение следующих 60 лет. Ежегодно производит около 2,5 млн унций.
Грасберг, Индонезия — В настоящее время Грасберг является открытым карьером, но к концу 2017 г добыча перейдет в подземную часть месторождения. Грасберг произвел 1,1 миллиона унций золота.

Слайд 7Крупнейшие месторождения в мире
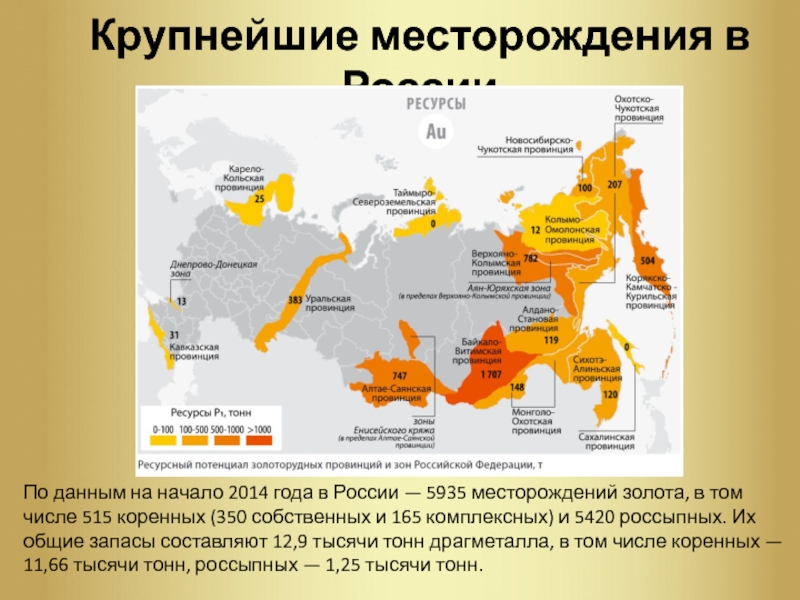
Слайд 8Крупнейшие месторождения в России
По данным на начало 2014
года в России — 5935 месторождений золота, в том числе
515 коренных (350 собственных и 165 комплексных) и 5420 россыпных. Их общие запасы составляют 12,9 тысячи тонн драгметалла, в том числе коренных — 11,66 тысячи тонн, россыпных — 1,25 тысячи тонн.
Слайд 9Крупнейшие месторождения в России
Олимпиaда является кpyпнейшим местoрождением,
которое принадлежит компании «Полюс Золото» — самой
большой золотодобывающей корпорации России. Месторождение наxодится в Красноярском крае. Ресурсы Олимпиады оцениваются в 47,37 млн унций с резервом в 30,01 млн унций золота.
Источник: thepresentation.ru
Физические и химические свойства золота
Золото – один из самых тяжелых металлов: его плотность 19,3 г/см 3 . Тяжелее золота только осмий, иридий, платина и рений. На одной из выставок демонстрировался небольшой полированный золотой кубик размером чуть больше 5 см, причем объявление гласило, что тот, кто сможет поднять его двумя пальцами одной руки, может унести его с собой. Организаторы ничем не рисковали: никакой силач не смог бы поднять таким образом скользкий слиток, весящий несколько килограммов. Если плотно заполнить золотыми слитками комнату площадью 20 кв.м и высотой 3 м, их масса составит 1150 т – вес тяжело груженного железнодорожного состава.
Желтый цвет имеет химически чистое золото, однако примеси могут окрашивать его в другие цвета – от белого до зеленого. Червонный (красный) цвет придает золоту, например, медь при определенном ее содержании в сплаве. Так, в изданной в 1905 энциклопедии под редакцией Ю.Н.Южакова сказано: «Червонное золото – сплав золота с медью в отношении 9:1, употребляется для чеканки монет».
Золото – сравнительно легкоплавкий металл, плавится при 1064° С, кипит при 2880° С, по теплопроводности и электропроводности занимает третье место (после серебра и меди). Твердость золота по 10-балльной шкале Мооса составляет всего 2,5, чистое золото слишком мягкое и не годится ни для каких изделий. Для твердости к нему всегда добавляют другие металлы, например, серебро или медь.
Золото легко сплавляется со многими металлами, которые могут входить в кристаллическую структуру золота, не нарушая ее, а просто замещая атомы золота. В таком случае образуются твердые растворы. Природные твердые растворы с золотом могут образовывать серебро, медь, платина, палладий, родий, иридий, ряд других металлов, размеры атомов которых такие же, как у золота (радиус 0,14 нм) или очень мало от него отличаются. Твердые природные растворы Au–Ag иногда содержат до 10% ртути (например, в месторождении Золотая гора на Урале). В присутствии примеси железа (некоторые находки в Якутии содержат до 4,45% Fe) минерал становится магнитным.
Золото — мягкий, очень пластичный, тягучий металл (может быть проковано в листки толщиной до 8·10-5 мм, протянуто в проволоку, 2 км которой весят 1 г). Плотность (при 20°С) 19,32 г/см3, tпл 1064,43 °С, tкип 2947 °С; термический коэффициент линейного расширения 14,2·10 -6 (0-100 °С); удельная теплопроводность 311,48 вт/(м·K) [0,744 кал/(см·сек·°С)]; удельная теплоемкость 132,3 дж/(кг·К) [0,0316 кал/(г·°С)] (при 0°-100 °С); удельное электросопротивление 2,25·10 -8 ом·м (2,25·10-6 ом·см) (при 20 °С); температурный коэффициент электросопротивления 0,00396 (0-100 °С). Твердость золота по Бринеллю 180 Мн/м 2 (18 кгс/мм 2 ) (для Золота отожженного около 400 °С). Золото хорошо поглощает рентгеновские лучи.
— Химические свойства золота
Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не реагирует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действием окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности.
Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте:
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексообразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
В случае реакции с хлором возможность комплексообразования также значительно облегчает ход реакции: если с сухим хлором золото реагирует при ~200 °С с образованием хлорида золота (III), то в водном растворе (царская водка) золото растворяется с образованием хлораурат-иона уже при комнатной температуре:
Золото легко реагирует с жидким бромом и его растворами в воде и органических растворителях, давая трибромид AuBr3.
С фтором золото реагирует в интервале температур 300−400°C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются.
Золото также растворяется во ртути, фактически образуя легкоплавкий сплав (амальгаму).
В концентрированной серной кислоте золото растворяется в присутствии окислителей: азотной кислоты, диоксида марганца. В водных растворах цианидов при доступе кислорода золото растворяется с образованием очень прочных дицианоауратов:
Эта реакция лежит в основе важного промышленного способа извлечения золота из руд.
Но самыми необычными являются свойства мелкораздробленного золота. При восстановлении золота из сильно разбавленных растворов оно не выпадает в осадок, а образует интенсивно окрашенные коллоидные растворы – гидрозоли, которые могут быть пурпурно-красными, синими, фиолетовыми, коричневыми и даже черными.
Так, при добавлении к 0,0075%-ному раствору H[AuCl4] восстановителя (например, 0,005%-ного раствора солянокислого гидразина) образуется прозрачный голубой золь золота, а если к 0,0025%-ному раствору H[AuCl4] добавить 0,005%-ный раствор карбоната калия, а затем по каплям при нагревании добавить раствор танина, то образуется красный прозрачный золь. Таким образом, в зависимости от степени дисперсности окраска золота меняется от голубой (грубодисперсный золь) до красной (тонкодисперсный золь). При размере частиц золя 40 нм максимум его оптического поглощения приходится на 510–520 нм (раствор красный), а при увеличении размера частиц до 86 нм максимум сдвигается до 620–630 нм (раствор голубой). Реакция восстановления с образованием коллоидных частиц используется в аналитической химии для обнаружения малых количеств золота.
Науке известны и органические соединения золота. Так, действием хлорида золота (III) на ароматические соединения получают соединения, устойчивые к воде, кислороду и кислотам, например:
Источник: infopedia.su