Техническим термином «цветные металлы» называют все металлы и сплавы, не содержащие в своем составе железа – в большинстве европейских языков для их обозначения используется словосочетание «нежелезные металлы». Активное применение цветных металлов характерно для стабильно развивающихся промышленных отраслей – машиностроения, атомной физики, авиационной индустрии, сферы высоких технологий. Отрасль, которая занимается добычей необходимых руд, их обогащением и выплавкой готового материала называют цветная металлургия.
Цветные металлы: их свойства и применение
- легкими (алюминий, натрий, титан, барий, магний). Отличаются самой низкой удельной массой;
- тяжелыми (никель, медь, олово, свинец, цинк) Сырьем для них служат сульфидные и окисленные полиметаллические руды;
- благородными, особо стойкими к воздействию корродирующих факторов и окислению (золото, серебро, платина, иридий, осмий);
- тугоплавкими, с высокой износостойкостью (вольфрам, цирконий, молибден, хром);
- редкоземельными – их отличает серебристо-белый цветовой оттенок (скандий, европий, гольмий и пр.);
- радиоактивными (уран, радий, торий);
- рассеянными, не встречающимися в природе в виде отдельных элементов (таллий, селен, рубидий);
- малыми (висмут, ртуть, кобальт), добыча которых ведется в небольших количествах.
Каждая группа обладает набором характеристик, который предопределяет область применения, но имеет и общий ряд положительных и отрицательных свойств.
История платины в России . Драгоценные металлы
Плюсы и минусы цветных металлов
К недостаткам относят низкую механическую прочность многих их видов и сплавов, особенно при нагревании, отсутствие магнитного напряжения, высокую стоимость.
Плюсы цветных металлов:
- электропроводимость;
- коррозионная стойкость;
- высокая теплопроводность;
- инертность при контакте с агрессивными средами;
- долговечность.
Минусы и плюсы материалов могут меняться местами в зависимости от специфики практического применения, а их обработку на выгодных условиях можно заказать в компании ООО ПКФ «ЧМП».
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Источник: chelplazma.ru
Металлургия платины
Подобно золоту, платина встречается в рудах и россыпях.
Россыпи, образовавшиеся в результате разрушения и переноса поверхностными водами вещества коренных массивов, включают платину в виде частиц сплавов с другими металлами и химических соединений различной крупности – от тонкой пыли до 30–50 мм в поперечнике. Более крупные самородки встречаются редко, но иногда масса их достигает нескольких килограммов.
В палладистой платине 7–37 % палладия, в иридистой до 30 % иридия, а более богатые сплавы называют самородным иридием.
Платина — Самый ДРАГОЦЕННЫЙ Металл на ЗЕМЛЕ!
В числе природных химических соединений следует упомянуть сперрилит (PtAs2), куперит (PtS), брэггит (Pt, Pd, Ni)S и иные минералы более сложного состава, содержащие медь, олово, теллур, висмут и другие элементы, они встречаются отдельно и в сростках.
Добыча и обогащение россыпей во многом сходны с добычей и обогащением золота. Шлиховой материал, главную массу которого составляет платина, имеет, например, такой состав:

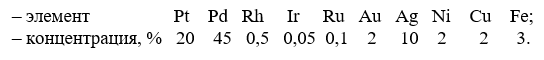
Из сравнения цифр видно, что в шлихах больше платины, а в концентратах – палладия, кроме того, в последних чаще встречаются золото и серебро. Общие основы переработки шлихов и концентратов одинаковы; однако технология на разных заводах часто включает различные переделы из-за особенностей сырья и местных условий. Вследствие близости свойств платиноидов схемы их разделения обычно весьма сложны и разветвлены. Опуская это многообразие, мы ограничиваемся ниже только кратким описанием одного из наиболее простых вариантов.
Переработка шлихов и концентратов
Для перевода благородных металлов в раствор издавна пользуются смесью соляной и азотной кислот – царской водкой, известной еще древним алхимикам. Действие ее объясняется одновременным окислением и комплексообразованием, как это видно из следующей схемы:
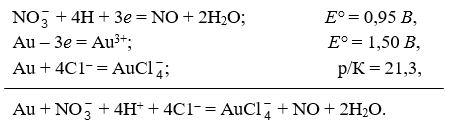
Платина, палладий и частично иридий переходят в раствор по подобным реакциям и следующей общей схеме:
![]()
После суточного нагревания и перемешивания в раствор практически полностью переходят палладий, золото и платина, а иридий — только частично. В нерастворимом остатке, масса которого около 5 %, например, содержится 30 % иридия, 12 % рутения, 10 % платины, и 3 % родия.
Платину из фильтрата осаждают хлористым аммонием в виде труднорастворимого гексахлороплатината (IV) аммония. Для получения чистого осадка иридий и палладий предварительно восстанавливают. Применяют разные восстановители, например, сульфат железа (II), который одновременно осаждает золото:
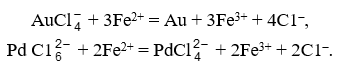
Промытый и высушенный осадок гексахлороплатината (IV) аммония прокаливают при температуре 800 °С, получая ковкий серый порошок металла – платиновую губку, которая обычно требует еще сложной дополнительной очистки.
Палладий переводят в тетрахлоропалладат (II) аммония добавлением аммиака, а затем, осторожно подкисляя раствор соляной кислотой, выделяют желтый кристаллический осадок транс-дихлордиаминопалладия (хлорпалладозамина):
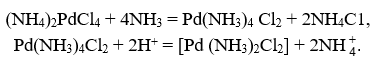
Прокаливая эту соль, получают порошок палладия.
Остаток от обработки царской водкой диспергируют – плавят со свинцом, гранулируют и растворяют в азотной кислоте. В раствор отходят серебро и свинец, а мелкий порошок платиноидов для выделения родия сплавляют с бисульфатом натрия и выщелачивают водой.
Родий в виде Rh2(SO4)3 растворяется. Действием щелочи осаждают его гидрооксид, который вновь растворяют:
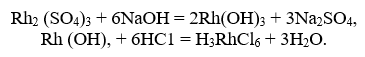
Далее, в слабокислой среде выделяют осадок гексанитрородиата (III) натрия:
![]()
Действием соляной кислоты эту соль переводят в (NH4)3RhCl6, и, прокаливая последнюю, получают родиевую губку.
Рутений и иридий спекают с перекисью натрия при температуре 500 °С. Выщелачивание спека дает раствор Na2RuО4 и остаток IrO2.
Четырехокcид рутения отгоняют в токе хлора и поглощают раствором соляной кислоты. Добавляя хлористый аммоний, осаждают коричневые кристаллы (NH4)2RuCl6, которые после сушки восстанавливают в среде водорода с получением при 1000 °С порошка рутения.
Двуоксид иридия растворим в соляной кислоте. Действием хлорида аммония из раствора осаждают гексахлороиридат аммония(NH4)2IrCl6, прокаливание его дает порошок иридия.
Осмий часто встречается в виде сплава с иридием – осмистого иридия, на который царская водка практически не действует. При необходимости извлечения осмия нерастворимый остаток диспергируют плавкой с цинком и выщелачиванием соляной кислотой.
Мелкий порошок спекают с ВаО2, обрабатывают спек смесью соляной и азотной кислот, а затем отгоняют осмий в виде весьма ядовитых паров OsO4. В поглотителе с раствором щелочи получают Na2OsO4, который восстанавливают тиосульфатом, и осмий осаждают в виде соли Фреми [OsO2(NH3)4]Cl2, при прокаливании она дает осмиевую губку. Одна из схем переработки концентрата дана на рис. 104.
Источник: metallurgist.pro
Металлургия платины
Подобно золоту, платина встречается в рудах и россыпях.
Россыпи, образовавшиеся в результате разрушения и переноса поверхностными водами вещества коренных массивов, включают платину в виде частиц сплавов с другими металлами и химических соединений различной крупности – от тонкой пыли до 30–50 мм в поперечнике. Более крупные самородки встречаются редко, но иногда масса их достигает нескольких килограммов.
По составу различают железистую платину (
В палладистой платине 7–37 % палладия, в иридистой до 30 % иридия, а более богатые сплавы называют самородным иридием.
В числе природных химических соединений следует упомянуть сперрилит (PtAs2), куперит (PtS), брэггит (Pt, Pd, Ni)S и иные минералы более сложного состава, содержащие медь, олово, теллур, висмут и другие элементы, они встречаются отдельно и в сростках.
Добыча и обогащение россыпей во многом сходны с добычей и обогащением золота. Шлиховой материал, главную массу которого составляет платина, имеет, например, такой состав:


Из сравнения цифр видно, что в шлихах больше платины, а в концентратах – палладия, кроме того, в последних чаще встречаются золото и серебро. Общие основы переработки шлихов и концентратов одинаковы; однако технология на разных заводах часто включает различные переделы из-за особенностей сырья и местных условий. Вследствие близости свойств платиноидов схемы их разделения обычно весьма сложны и разветвлены. Опуская это многообразие, мы ограничиваемся ниже только кратким описанием одного из наиболее простых вариантов.
Переработка шлихов и концентратов
Для перевода благородных металлов в раствор издавна пользуются смесью соляной и азотной кислот – царской водкой, известной еще древним алхимикам. Действие ее объясняется одновременным окислением и комплексообразованием, как это видно из следующей схемы:

Платина, палладий и частично иридий переходят в раствор по подобным реакциям и следующей общей схеме:
![]()
После суточного нагревания и перемешивания в раствор практически полностью переходят палладий, золото и платина, а иридий — только частично. В нерастворимом остатке, масса которого около 5 %, например, содержится 30 % иридия, 12 % рутения, 10 % платины, и 3 % родия.
Платину из фильтрата осаждают хлористым аммонием в виде труднорастворимого гексахлороплатината (IV) аммония. Для получения чистого осадка иридий и палладий предварительно восстанавливают. Применяют разные восстановители, например, сульфат железа (II), который одновременно осаждает золото:

Промытый и высушенный осадок гексахлороплатината (IV) аммония прокаливают при температуре 800 °С, получая ковкий серый порошок металла – платиновую губку, которая обычно требует еще сложной дополнительной очистки.
Палладий переводят в тетрахлоропалладат (II) аммония добавлением аммиака, а затем, осторожно подкисляя раствор соляной кислотой, выделяют желтый кристаллический осадок транс-дихлордиаминопалладия (хлорпалладозамина):

Прокаливая эту соль, получают порошок палладия.
Остаток от обработки царской водкой диспергируют – плавят со свинцом, гранулируют и растворяют в азотной кислоте. В раствор отходят серебро и свинец, а мелкий порошок платиноидов для выделения родия сплавляют с бисульфатом натрия и выщелачивают водой.
Родий в виде Rh2(SO4)3 растворяется. Действием щелочи осаждают его гидрооксид, который вновь растворяют:

Далее, в слабокислой среде выделяют осадок гексанитрородиата (III) натрия:
![]()
Действием соляной кислоты эту соль переводят в (NH4)3RhCl6, и, прокаливая последнюю, получают родиевую губку.
Рутений и иридий спекают с перекисью натрия при температуре 500 °С. Выщелачивание спека дает раствор Na2RuО4 и остаток IrO2.
Четырехокcид рутения отгоняют в токе хлора и поглощают раствором соляной кислоты. Добавляя хлористый аммоний, осаждают коричневые кристаллы (NH4)2RuCl6, которые после сушки восстанавливают в среде водорода с получением при 1000 °С порошка рутения.
Двуоксид иридия растворим в соляной кислоте. Действием хлорида аммония из раствора осаждают гексахлороиридат аммония(NH4)2IrCl6, прокаливание его дает порошок иридия.
Осмий часто встречается в виде сплава с иридием – осмистого иридия, на который царская водка практически не действует. При необходимости извлечения осмия нерастворимый остаток диспергируют плавкой с цинком и выщелачиванием соляной кислотой.
Мелкий порошок спекают с ВаО2, обрабатывают спек смесью соляной и азотной кислот, а затем отгоняют осмий в виде весьма ядовитых паров OsO4. В поглотителе с раствором щелочи получают Na2OsO4, который восстанавливают тиосульфатом, и осмий осаждают в виде соли Фреми [OsO2(NH3)4]Cl2, при прокаливании она дает осмиевую губку. Одна из схем переработки концентрата дана на рис. 104.
Источник: metallolome.ru