Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
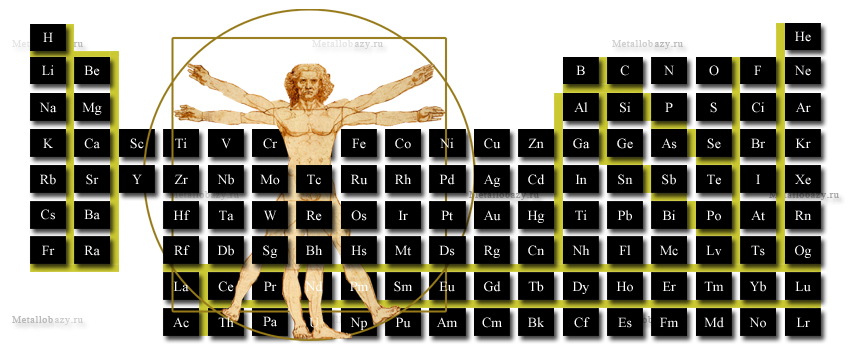
Периодическая таблица Д.И.Менделеева как пользоваться
ПЕРИОДИЧЕСКАЯ СИСТЕМА
Для вывода информации об элементе в центральном окне необдходимо кликнуть на соответствующую ячейку периодической таблицы представленной ниже.
Периодическая система элементов
Периодическая система элементов состоит из горизонтальных рядов — периодов и вертикальных столбцов — групп. Существующие в природе и синтезированные учеными элементы расположены в 7 периодах.
называется горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным газом. Исключение из этого правила представляет самый короткий I период, начинающийся водородом. Период это последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns 1 до ns 2 np 6 (или до ns 2 у первого периода). Периоды начинаются с s- элемента и заканчиваются p- элементом (у первого периода s- элементом). Малые периоды содержат 2 и 8 элементов, большие периоды — 18 и 32 элемента.
Первый период состоит всего из двух элементов — водорода и гелия. Второй и третий периоды включают по 8 элементов. Эти элементы образуют так называемые группы А, которые нумеруются от группы IA (водород, литий, натрий и т.д.) до группы 0 (благородные газы: гелий, неон, аргон и т.д.). Четвертый и пятый периоды содержат по 18 элементов.
К уже существующим элементам добавляются элементы группы В, которые располагаются между группой IIА (бериллий, магний, кальций и т.д.) и группой IIIА (бор, алюминий, галлий и т.д.). Группы нумеруются следующим образом. Сначала идут группы с IIIВ (скандий, иттрий, лантан) до VIIIВ.
В группе VIIIВ в каждом периоде находятся по три элемента (подгруппы: железо, рутений, осмий; кобальт, родий, иридий; никель, палладий, платина). После группы VIIIB следуют группа IB (медь, серебро, золото) и группа IIВ (цинк, кадмий, ртуть). В короткопериодном варианте элементы с одинаковым номером групп, но разными буквами образуют один столбец. В длиннопериодном варианте элементы группы В образуют отдельный блок; в этом случае очень часто все группы элементов нумеруются подряд — с 1-го до 18-го. В шестом и седьмом периодах, содержащих по 32 элемента «дополнительные» 14 элементов образуют близкие по свойствам семейства элементов: лантаноиды (редкоземельные элементы) и актиноиды, которые размещаются отдельно от всех остальных элементов внизу таблицы.
Учим названия химических элементов за 5 минут
объединяет элементы, имеющие одинаковую высшую валентность (валентность по кислороду). Высшая валентность равна номеру группы (исключения: O, F; Cu, Ag, Au; Fe, Co, Ni и некоторые другие элементы). Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы — аналоги).
К главным подгруппам (подгруппам А) относятся подгруппы элементов второго периода: Li, Be, B, C, N, O, F и подгруппа благородных газов. К побочным подгруппам (подгруппам В) принадлежат d- и f- элементы. Первые шесть d- элементов от (Se до Fe) начинают соответствующие подгруппы от подгруппы III (Se) до подгруппы VIII (Fe).
В подгруппу VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги — платиновые металлы. Медь и ее аналоги, имеющие во внешней s- подоболочке по одному электрону, образуют первую побочную подгруппу. Лантоноиды и актиноиды (f- элементы) находятся в III подгруппе в соответствие с особенностями их электронных конфигураций.
называется вертикальный ряд элементов, имеющих сходное строение внешнего электронного слоя и близкие химические свойства. Главные подгруппы содержат элементы малых и больших периодов. Побочные подгруппы содержат элементы только больших периодов.
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от зарядов их ядер (порядковых номеров элементов в периодической системе).
Закономерности в периодической системе
В периодической системе строго соблюдается ряд закономерностей, связанных со строением электронных оболочек атомов. Эти закономерности таковы:
- Число электронных слоев в атоме элемента равно номеру периода, в котором данный элемент находится. Например, у атома H и He всего один электронный слой, у атома C — два электронных слоя, у атома Cl — три, у атома Fr — семь и т.д.
- Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно номеру группы, в которой находится данный элемент. Например, атом натрия находится в I группе и имеет 1 электрон в наружном слое, атом кремния находится в IV группе и имеет 4 электрона в наружном слое, атомы инертных газов расположены в VIII группе и имеют 8 внешних электронов.
Электроны (1-7) незавершенного внешнего слоя участвуют в образовании химических связей и являются валентными.
В побочных подгруппах распределение валентных электронов более сложное, чем в главных подгруппах. Общее число подвижных валентных электронов также равно номеру группы, но только 2 (реже 1) из них находятся во внешнем слое, а остальные помещаются в предпоследний слой.
- В периодической системе сверху вниз по группе увеличивается металлическая активность элементов, т.е. способность отдавать электроны (поскольку с ростом порядкового номера растет число электронных слоев и ослабевает связь внешних электронов с ядром).
- В периодической системе слева направо по периоду увеличивается неметаллическая активность, т.е. способность принимать электроны (поскольку с ростом порядкового номера увеличивается число электронов во внешнем электронном слое, отдавать их становится все труднее, более выгодной будет тенденция дополнить внешний слой до устойчивой восьми электронной оболочки).В соответствии с вышеприведенными закономерностями самым активным металлом является франций, самым активным неметаллом является фтор. Вблизи диагонали, разделяющей эти два полюса, расположены элементы переходного и амфотерного характера: бор, алюминий, германий, мышьяк, теллур, астат и др. Необходимо уметь свободно ориентироваться в закономерностях периодической системы; по месту нахождения элемента в таблице рассказать о его свойствах, характерных валентных состояниях, важнейших соединениях.
Источник: proofgen.ru
А вы знали, что 69,5% элементов таблицы Менделеева — это металлы ?
Скорее всего, русский ученый Дмитрий Иванович Менделеев, отец и создатель таблицы химических элементов, и не подозревал, к чему приведут его двадцатилетние труды, и как упорядоченная им таблица — увековечит его имя на века. Да, да, именно — упорядоченная.
Элементы химической таблицы Менделеева
Мало кто знает об этом, но Дмитрий Иванович не единственный ученый-химик, пытавшийся упорядочить (уже известные на тот момент) химические элементы в единую таблицу. В тот период развития человеческого мышления, были и другие ученые, ставившие перед собой аналогичные задачи.
Из таких господ можно перечислить итальянского химика Станислав Канниццаро, предложившего теорию составления таблицы — используя атомный вес каждого элемента. Или французского химика-геолога Александра Эмиль Шанкуртуа, создавшего на размеченном цилиндре — свой винтовой график химических элементов. Таковых было много и много, но выдающегося результата добился только Менделеев, с его таблицей на основе зависимости различных свойств элементов от их заряда атомного ядра. Хоть наша страница не совсем об этом — но и не-упомянуть об этом факте было бы недопустимо.
Как известно, в таблице Дмитрий Ивановича содержится 118 химических элементов. Из этих 118 элементов — 85 элемента являются (в том или ином виде) металлами.
Давайте перечислим их:
- Литий (Li) третий химический элемент в таблице, входит в группу щелочных металлов. Открыт в 1817 году шведским химиком Иоганном Арфведсоном;
- Берилий (Be) четвертый элемент таблицы, один из относительно твердых металлов. Открыт в 1798 году французским химиком Луи Никола Вокленом;
- Натрий (Na) одиннадцатый элемент таблицы, входит в группу мягких щелочных металлов;
- Магний (Mg) двенадцатый элемент был открыт в 1695 году в Англии, и назван аптекарями Англии «горькой солью»;
- Алюминий (Al) тринадцатый элемент, открыт датским физиком Гансом Эрстедом в 1825 году. Благодаря стойкости к коррозии, и легко поддающейся формовке — является одним из часто применяемых металлов в промышленности;
- Калий (K) девятнадцатый элемент, ;
- Кальцый (Ca) двадцатый элемент
- Скандий (Sc) двадцать первый элемент
- Титан (Ti) двадцать второй элемент
- Ванадий (V) двадцать третий элемент
- Хром (Cr) двадцать четвертый элемент
- Марганец (Mn) двадцать пятый элемент
- Железо (Fe) двадцать шестой элемент
- Кобальт (Co) двадцать седьмой элемент
- Никель (Ni) двадцать восьмой элемент
- Медь (Cu) двадцать девятый элемент
- Цинк (Zn) тридцатый элемент
- Галлий (Ga) тридцать первый элемент
- Рубидий (Rb) тридцать седьмой элемент
- Стронций (Sr) тридцать восьмой элемент
- Иттрий (Y) тридцать девятый элемент
- Цирконий (Zr) сороковой элемент
- Ниобий (Nb) сорок первый элемент
- Молибден (Mo) сорок второй элемент
- Технеций (Tc) сорок третий элемент
- Рутений (Ru) сорок четвертый элемент
- Родий (Rh) сорок пятый элемент
- Палладий (Pd) сорок шестой элемент
- Серебро (Ag) сорок седьмой элемент
- Кадмий (Cd) сорок восьмой элемент
- Индий (In) сорок девятый элемент
- Олово (Sn) пятидесятый элемент
- Цезий (Cs) пятьдесят пятый элемент
- Барий (Ba) пятьдесят шестой элемент
- Лантан (La) пятьдесят седьмой элемент
- Церий (Ce) 58
- Празеодим (Pr) 59
- Неодим (Nd) 60
- Прометий (Pm) 61
- Самарий (Sm) 62
- Европий (Eu) 63
- Гадолиний (Gb) 64
- Тербий (Tb) 65
- Диспрозий (Dy) 66
- Гольмий (Ho) 67
- Эрбий (68) Er
- Тулий (Tm) 69
- Иттербий (Yb) 70
- Лютеций (Lu) 71
- Графний (Hf) семьдесят второй элемент
- Тантал (Ta) семьдесят третий
- Вольфрам (W) семьдесят четвертый
- Рений (Re) семьдесят пятый элемент
- Осмий (Os) семьдесят шестой элемент
- Иридий (Ir) семьдесят седьмой элемент
- Платина (Pt) семьдесят восьмой элемент
- Золото (Au) семьдесят девятый элемент
- Ртуть (Hg) восьмидесятый элемент
- Таллий (Tl) восемьдесят первый элемент
- Свинец (Pb) восемьдесят второй элемент
- Висмут (Bi) восемьдесят третий элемент
- Полоний (Po) восемьдесят четвертый элемент
- Франций (Fr) восемьдесят седьмой элемент
- Радий (Ra) восемьдесят восьмой элемент
- Актиний (Ac) восемьдесят девятый элемент
- Торий (Th) 90
- Протактиний (Pa) 91
- Уран (U) 92
- Нептуний (Np) 93
- Плутоний (Pu) 94
- Америций (Am) 95
- Кюрий (Cm) 96
- Берклий (Bk) 97
- Калифорний (Cf) 98
- Эйнштений (Es) 99
- Фермий (Fm) 100
- Менделевий (Md) 101
- Нобелий (No) 102
- Лоуренсий (Lr) 103
- Резенфордий (Rf) сто четвертый элемент
- Дубний (Db) сто пятый элемент
- Сиборгий (Sg) сто шестой элемент
- Борий (Bh) сто седьмой элемент
- Хассий (Hs) сто восьмой элемент
- Мейтнерий (Mt) сто девятый элемент