Ответ от Елена Казакова[гуру]
В периодической системе 8 вертикальных столбцов, названных группами. В группах объединены
сходные по свойствам элементы, принадлежащие одному семейству. Номера групп обозначены
вверху таблицы римской цифрой. Валентность элементов каждой группы соответствует, за
немногими исключениями, номеру группы.
Каждая группа элементов делится на главную и побочную подгруппы. Главные подгруппы
образуют элементы малых и больших периодов, а побочные – только элементы больших
периодов. Элементы главных и побочных подгрупп сдвинуты в разные стороны.
Те элементы, которые расположены строго под элементами II (и III) периодов, составляют главную подгруппу. Те элементы IV-VII периодов, которые сдвинуты в сторону относительно элементов II (и III) периодов, составляют побочную подгруппу. Например, для IV периода к главной подгруппе относятся K, Ca, Ga, Ge,As, Se, Br Kr. Обратите внимание, что их всегда 8 (кроме неполного VII периода). А к побочно подгруппе относятся Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn. Обратите внимание, что их всегда 10 (кроме неполного VII периода) .
Химия. Как найти, где главная и где побочная подгруппы?
Для элементов, расположенных в одной и той же группе, наблюдаются следующие закономерности:
1. Наибольшая (высшая) валентность элементов каждой группы по кислороду (за немногими
исключениями) соответствует номеру группы. Элементы побочных подгрупп могут проявлять и
другую валентность. Например, медь образует оксиды одновалентной и двухвалентной меди,
соответственно Сu2О (I) и СuО (II). Однако наиболее распространенными, являются соединения
двухвалентной меди.
2. В главных подгруппах с увеличением относительных атомных масс, усиливаются
металлические свойства элементов.
3. Неметаллические свойства у элементов главных подгрупп с увеличением порядкового номера
ослабевают. Так, в главной подгруппе VII группы (подгруппе галогенов) наиболее активным
неметаллом является фтор F, а наименее активным – иод I.
4. Элементы главных подгрупп IV – VII групп образуют так же соединения с водородом.
Валентность элементов в соединениях с водородом определяется разностью между числом 8 и
номером группы.
Сущность деления групп на две подгруппы: главную и побочную, можно объяснить и на
основании теории строения атома. Так, к главным подгруппам относятся те элементы, у которых
происходит заполнение наружного энергетического уровня S-и p-электронами.
Число валентных электронов на внешнем уровне у этих элементов совпадает с номерам группы.
У элементов побочных подгрупп d-е поступают на предпоследний энергетический уровень, он
относятся к d- элементам. Валентными у этих элементов будут d – электроны и электроны
внешнего уровня.
Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют одинаковое
строение внешнего электронного уровня.
Таким образом, деление групп на подгруппы (главную и побочную) основано на различии в заполнении электронами энергетических уровней. Главную подгруппу составляют s- и p-элементы, а побочную подгруппу — d-элементы. В каждой группе объединены элементы, атомы которых имеют сходное строение внешнего энергетического уровня. При этом атомы элементов главных подгрупп содержат на внешних (последних) уровнях число электронов, равное номеру группы. Это так называемые — валентные электроны.
У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вто-рых снаружи) уровней, в чем и состоит основное различие в свойствах элементов главных и побочных подгрупп.
Главная подгруппа — содержит элементы, у которых идет заполнение s- и р- подуровней. Сверху вниз по подгруппе наблюдается усиление металлических (и ослабление неметаллических) свойств.
Ответ от Ольга[гуру]
Главная подгруппа содержит элементы малых и больших периодов, а побочная — только больших.
Ответ от Ирина Карпова[гуру]
Элементы главных подгрупп находятся слева, а побочных справа
Ответ от Майя Полевая[гуру]
смотри в самых верхних строках (1 и 2 периоды) , с какой стороны элементы. Чуть правее или левее, не важно. Но это и есть главная подгруппа. Все те, которые стоят строго под ними — главная, а с другого края будет побочная. (Мы говорим об одном столбце).
Ответ от Михаил Бармин[гуру]
По ЦВЕТУ!! с и п элементы обчно КРАСНОГО И ЖЕЛТОГО ЦВЕТА -ГЛАВНЫЕ
Ответ от Андрей Степанов[активный]
1,2,3 периодах (малые) все в главной подгруппе (т. к. их символ находиться с лева)
4,5,6 периодах (большие) 8 эл-тов из главной подгруппы и 10 эл-тов из побочной
7 периоде (незаконченный) просто смотреть как и абсолютно везде
по местоположению символа в клетке таблицы
если слева — в главной подгруппе, если справа — в побочной
Ответ от Андрей трифанов[новичек]
П
Ответ от Luka3321[новичек]
главные группы это те элементы что пишутся слево, а побочные подгруппы это те элементы что пишутся с право.
Ответ от Valentin8110[новичек]
фыв
Ответ от 22 ответа[гуру]
Привет! Вот подборка тем с похожими вопросами и ответами на Ваш вопрос: как отличить главную подргуппу от побочной в таблице менделеева? СРОООЧНО.
Группа периодической системы на Википедии
Посмотрите статью на википедии про Группа периодической системы
Источник: 22oa.ru
Укажите, в какой подгруппе (главной или побочной) находятся элементы: а) азот, теллур, молибден, серебро; б) мышьяк, натрий, гелий, железо.
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
Готовимся к углубленному изучению химии
В атомах элементов I периода ( Н и Не) электроны заполняют один энергетический уровень (К); в атомах элементов II периода (от Li до Ne) электроны заполняют два энергетических уровня (К и L); в атомах элементов III периода (от Na до Ar) – три энергетических уровня (К, L и М); в атомах элементов IV периода (от К до Кr) – четыре энергетических уровня (К, L, М и N).
Число заполняемых энергетических уровней (электронных слоев) в атомах всех элементов данного периода равно номеру периода. Поэтому можно дать следующее определение периода:
Период – это последовательность элементов, атомы которых имеют одинаковое число электронных слоев. Это число равно номеру периода.
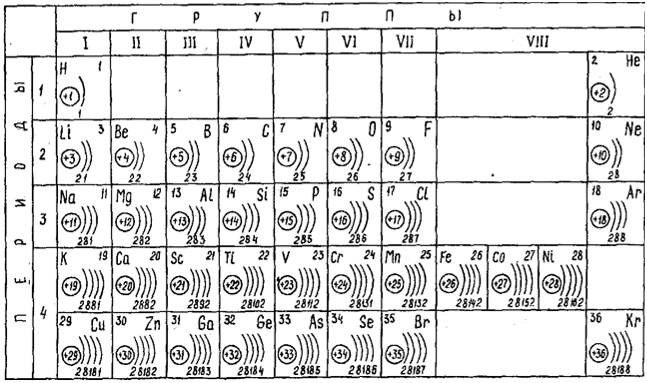
В атомах всех известных элементов электроны заполняют от1 до 7 энергетических уровней, поэтому периодическая система состоит из семи периодов.
Каждый период начинается щелочным металлом, в атомах которого на внешнем электронном слое имеется один s-электрон; электронное строение внешнего слоя – ns 1 ( n – номер периода).
Каждый период заканчивается благородным газом. В атомах всех благородных газов (кроме Не) на внешнем электронном слое имеются два s- и шесть p-электронов, электронное строение внешнего слоя ns 2 np 6 ( n – номер периода).
Следовательно, число электронов на внешнем слое атомов элементов главных подгрупп (кроме Н и Не) равно номеру группы, в которой находятся элементы.
Поэтому главную подгруппу любой группы можно определить так:
Главная подгруппа – это вертикальный ряд элементов, атомы которых имеют одинаковое число электронов на внешнем электронном слое. Это число равно номеру группы.
Периодическое изменение свойств химических элементов и их соединений при увеличении порядкового номера объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов.
Все элементы разделяются на 4 электронных семейства.
s — элементы – это элементы, в атомах которых последним заполняется s — подуровень внешнего электронного слоя.
Первые два элемента каждого периода – это s -элементы. Они составляют главные подгруппы I и II групп.
p -элементы – это элементы, в атомах которых последним заполняется p — подуровень внешнего электронного слоя.
В каждом периоде имеется шесть p — элементов; они находятся в конце периода. p — элементы составляют главные подгруппы III – VIII групп.
d — элементы – это элементы, в атомах которых последним заполняется d — подуровень предвнешнего электронного слоя.
В IV – VI больших периодах имеется по десять d -элементов. В IV и V периодах они находятся между s — и p — элементами. d — элементы составляют побочные подгруппы всех восьми групп.
Побочная подгруппа – это вертикальный ряд d — элементов, которые имеют одинаковое суммарное число электронов на d — подуровне предвнешнего слоя и s — подуровне внешнего слоя. Это число обычно равно номеру группы.

f -элементы – это элементы, в атомах которых последним заполняется f — подуровень третьего снаружи электронного слоя.
f -элементы находятся в VI и VII периодах. Каждый из этих периодов содержит 14 f -элементов. f — элементами являются лантаноиды и актиноиды, которые располагаются в нижней части периодической системы.
SHAPE * MERGEFORMAT

УПРАЖНЕНИЯ
1. Определить число главных и побочных подгрупп в ПСХЭ .
Решение:
Число главных подгрупп определяется максимальным числом электронов на s- и p-подуровнях.
Число переходных элементов в 4-м периоде (от 21Sc до 30Zn), в 5-м (от 39Y до 48Cd) и
6-м (57La и от 72Hf до 80Hg) периодах равно 10 в каждом случае.
Число переходных элементов равно максимальному числу электронов на d-подуровне (10). Именно поэтому на 3-м (М) уровне на 10 электронов больше, чем на 2-м (L). Поскольку в каждом большом периоде периодической системы Д.И.Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам:
4-й период – Fe–Co–Ni,
5-й период – Ru–Rh–Pd,
6-й период – Os–Ir–Pt,
то число побочных подгрупп . .
(Проверить по периодической системе, сколько в ней главных и побочных подгрупп.)
_____________________________________________________________
2. Определить (по аналогии с переходными элементами) число лантаноидов и актиноидов, вынесенных в виде самостоятельных рядов вниз периодической системы.
Оно должно быть равно разности между максимальным числом электронов на … и … энергетических уровнях. Это число равно максимальному числу электронов на …-подуровне.
(Сверить вывод с периодической системой.)
Таким образом, строгая периодичность расположения элементов в ПСХЭ полностью
объясняется . .
Периодическое изменение характера заполнения электронами внешних энергетических уровней вызывает периодические изменения химических свойств элементов и их соединений.
Электронные формулы элементов 2-го периода:
3 Li – 1s 2 2s 1 ,
6 С – 1s 2 2s 2 2p 2 ,
9F – 1s 2 2s 2 2p 5 ,
4 Be – 1s 2 2s 2 ,
7N – 1s 2 2s 2 2p 3 ,
10Ne – 1s 2 2s 2 2p 6 ,
5 B – 1s 2 2s 2 2p 1 ,
😯 – 1s 2 2s 2 2p 4 .
При переходе от Li к Ne заряд ядра (Z) постепенно увеличивается от +3 до +10, что вызывает увеличение сил притяжения электронов к ядру. В результате радиусы атомов в этом ряду уменьшаются.
Источник: himiy88.blogspot.com