1. При составлении уравнений ОВР важно уметь определять окислитель и восстановитель. Некоторые вещества могут быть только восстановителями. Это металлы и вещества, которые содержат элемент, изменяющий степень окисления, в низшей степени окисления (например: NH3, PH3, H2S, HCl, HBr, HI и их соли). Фтор и сложные вещества, содеожащие элемент в высшей степени окисления, могут быть только окислителями (например: HNO3, H2SO4, SO3, KMnO4, K2CrO4, K2Cr2O7).
2. Вещества, которые содержат элементы в промежуточной степени окисления, могут проявлять, в зависимости от природы реагента – как окислительные, так и восстановительные свойства. Это – все неметаллы (кроме фтора): N2, NO, HNO2, KNO2, H2O2, S, SO2 и другие.
В этой реакции оксид серы (IV) проявляет восстановительные свойства, т.к. реагирует с сильным окислителем – NO2.
В данной реакции SO2 проявляет окислительные свойства, т.к. реагирует с более сильным восстановителем – H2S.
3. На ход окислительно – восстановительных реакций в растворах влияет среда, в которой протекает реакция и, поэтому, окислительно – восстановительный процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов. Для создания кислой среды обычно используют разбавленную серную кислоту. Азотную и соляную применяют редко, т.к. первая является сильным окислителем, а вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксидов калия или натрия. Примеры влияния среды на характер продуктов ОВР:
Новый восстановитель Золота! Такого ты не знал #золото #gold
Кислоты – сильные окислители
Это серная кислота концентрированная и азотная кислота в любом виде. Они окисляют почти все металлы и такие неметаллы, как углерод, фосфор, серу, и многие сложные вещества.
Возможные продукты восстановления этих кислот:
При взаимодействии с металлами получаются три вещества: соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты, активности металла и температуры.
Чем меньше концентрация кислоты. А металл более активен, тем больше степень восстановления кислоты.
Представим возможные направления взаимодействия этих кислот с различными веществами в виде схем:
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до SO2 с неактивными до SO2, S или H2S
некоторыми с Fe,Al, Cr металлами и с металлами средней
другими неметаллами активности и активными,
металлами со сложными веществами
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до NO2 с неактив — до NO, N2O, N2 или
некоторыми с Fe, Al, Cr ными металлами, NH4NO3 (если кислота
другими неметаллами, очень разбавлена или
металлами сложными сказано, что газ не выделялся)
веществами с металлами средней активности и
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до NO с неактивными до NO, N2O, N2 или
некоторыми с Fe, Al, Cr металлами, неметаллами, NH4NO3 (если кислота
ОВР для чайников — Как определить Окислитель и Восстановитель #shorts #youtubeshorts
другими сложными веществами очень разбавлена или
металлами сказано, что газ не вы –
делялся) с металлами
средней активности и
Концентрированные H2SO4 и HNO3 реагируют с Fe, Al, Cr только при нагревании:
Концентрированная H2SO4 и HNO3 в любом виде окисляют неметаллы — восстановители — углерод, фосфор, серу — до соответствующих кислот.
Концентрированная азотная кислота окисляет йод до йодноватой кислоты:
Взаимодействие этих кислот со сложными веществами рассмотрим в следующем разделе.
Особое значение имеет ОВР между соляной и азотной кислотами. Смесь трёх объёмов соляной кислоты и одного объёма концентрированной азотной называют «царская водка», в ней растворяется даже золото, которое алхимики считали царём металлов:
В ряде случаев между веществами, которые проявляют сильные восстановительные и окислительные свойства, возможны только ОВР, а не реакции обмена:
1. Окислители – соединения железа (III), восстановители – сульфиды, йодиды. При этом катион Fe 3+ восстанавливается до катиона Fe 2+ , сульфид – анион S 2- окисляется до серы S 0 , а йодид – анион I — окисляется до йода I2.
В зависимости от количественного соотношения реагирующих веществ могут получиться различные соединения железа (II):
2FeCl3 + Na2S = S¯ + 2FeCl2 или 2FeCl3 + 3Na2S = S¯ + FeS + 6NaCl
2. Окислители – соединения меди (II), восстановители — йодиды. При этом катион Cu 2+ восстанавливается до катиона Cu + , а йодид – анион окисляется до йода I2 :
2CuCl2 + 4KI = 2CuI¯ + I2¯ + 4KCl
2CuCl2 + 4HI = 2CuI¯ + I2¯ + 4HCl
3. Окислитель – азотная кислота, восстановитель – сульфиды, йодиды, сульфиты. При этом азотная кислота, в зависимости от концентрации, восстанавливается до NO2 (концентрированная), до NO (разбавленная); сульфид – анион S 2- окисляется до серы S 0 или сульфат – аниона SO4 2- , йодид – анион – до йода I2, a сульфит – анион SO3 2- — до сульфат – аниона SO4 2- :
4. Окислитель – азотная кислота или серная концентрированная кислота, восстановитель – соединения железа (II). При этом азотная кислота восстанавливается до NO2 или NO, серная – до SO2, а катион Fe 2+ окисляется до катиона Fe 3+ :
5. Окислитель – серная кислота концентрированная, восстановитель – сульфиды, йодиды и бромиды. При этом серная кислота восстанавливается до SO2, S или H2S; сульфид – анион S 2- окисляется до серы S, SO2 или H2SO4; йодид – анион до йода I2, бромид – анион до брома Br2:
или 6HI + H2SO4 конц. = 3I2¯ + S¯ + 4H2O
6. Железная окалина – Fe3O4, это смесь двух оксидов — FeO и Fe2O3. Поэтому при взаимодействии с сильными окислителями она окисляется до соединения железа (III) за счёт катионов Fe 2+ — восстановителей, а при взаимодействии с сильными восстановителями восстанавливается до соединения железа (II) за счёт катионов Fe 3+ — окислителей:
При взаимодействии с большинством кислот происходит реакция обмена, получаются две соли:
1. Все галогены, кроме F2, диспропорционируют в растворах всех щелочей. При комнатной температуре или на холоде получаются две соли – МГ, МГО и Н2О; при нагревании – две соли: МГ, МГО3 и Н2О.
Cl2 +2KOH = KCl + KClO + H2O – на холоде,
3Cl2 + 6KOH = 5KCl +KClO3 + 3H2O – при нагревании,
Аналогично происходят реакции с растворами карбонатов:
2. Диспропорционирование серы в растворах щелочей:
Источник: poisk-ru.ru
Составление окислительно-восстановительных реакций соединений серебра, золота и платины
Задание 391
Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Серная кислота обладает окислительными свойствами (сходными со свойствами азотной кислоты), если её концентрация превосходит 70%. Только тогда можно говорить о специфических свойствах H2SO4, как окислителя.
Концентрированная серная кислота, как окислитель восстанавливается активными металлами (от Mg Cr) до H2S, малоактивными металлами (от Fe до Pb) – до свободной серы, а тяжёлыми, инертными металлами (отSb до Au) – до оксида серы (IV). При содержании H2SO4 в растворе менее 70% (разбавленная серная кислота) её поведение описывается в рамках обычных представлений. При взаимодействии разбавленной серной кислоты с металлами, стоящими в электрохимическом ряду напряжений левее водорода, выделяется газообразный водород. С металлами, стоящими в ряду напряжений правее водорода, разбавленная серная кислота не взаимодействует.
В концентрированной серной кислоте элементом-окислителем является атом серы (степень окисления +6), а в разбавленной – водород (степень окисления +1).
Уравнение реакции растворения серебра в концентрированной серной кислоте
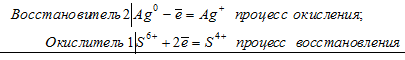
2Аg 0 + S 6+ = 2Ag + + S 4+
В данной реакции серебро увеличивает свою степень окисления от 0 до +1, т. е. проявляет свойства восстановителя, а сера уменьшает свою степень окисления от +6 до +4, т.е. проявляет свойства окислителя.
Задание 401
Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнения взаимодействия KI с сульфатом меди.
Решение:
Для меди характерна степень окисления +1 (Cu2O, CuCl, CuI, Cu2S) и +2 [CuO, CuSO4 . 5H2O, Cu(NO3)2 . 6H2O, CuS, Cu2(OH)2CO3]; для серебра: +1 (Ag2O, AgNO3, AgCl, AgBr, AgI); для золота: +3 (AuCl3, H[AuCl4]).
Как элементы 2-й группы медь, серебро и золото имеют по одному электрону на внешнем энергетическом уровне (ns 1 ), поэтому должны проявлять степень окисления +1. Характерная степень окисления, как у элементов 2-й группы должна быть +2. Для меди наиболее характерна степень окисления +2, для серебра +1, а для золота +3.
Уравнения взаимодействия KI с сульфатом меди
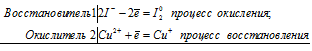
2Сu 2+ +2I — = Cu + + I2 0
Задание 404
Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Золото растворяется в «царской водке» с образованием комплекса H[AuCl4]
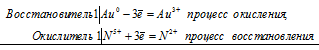
Au 0 +N 5+ = Au 3+ + N 2+
3Au + 12HCl + 3HNO3 = 3H[AuCl4] + 3NO + 6H2O
б) Золото растворяется в селеновой кислоте с образованием селената золота(III)
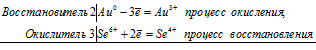
2Au 0 + 3Se 6+ = 2Au 3+ + 3Se 4+
Задание 428
Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий — до+8.
Решение:
а) Реакция растворения платины в царской водке
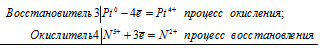
3Pt 0 + 4N 5+ = 3Pt 4+ + 4N 2+
б) Реакция взаимодействия осмия с фтором:
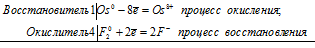
Os 0 + 4F2 0 = Os 8+ + 8F –
- Вы здесь:
- Главная

- Задачи

- Химия-Шиманович

- Серебро, золото, платина | Задания 391; 401; 404; 428
Источник: buzani.ru
mozok.click
• металлические элементы находятся преимущественно в нижней левой части Периодической системы, а неметаллические — в верхней правой.
• в высшей степени окисления — только окислители;
• в низшей — только восстановители;
• в промежуточной — и окислители, и восстановители.
Окислители и восстановители
Атомы химических элементов в высшей степени окисления могут быть только окислителями, поскольку они могут только принимать электроны.
Элементы в низшей степени окисления могут быть только восстановителями, поскольку они могут только отдавать электроны. Если элемент находится в промежуточной степени окисления, то он может как принимать, так и отдавать электроны, следовательно, может проявлять свойства как восстановителя, так и окислителя. Характерные степени окисления некоторых элементов и соответствующие им соединения приведены в Приложении 2.
Например, рассмотрим Сульфур и характерные для него соединения с разной степенью окисления этого элемента. В гидроген сульфиде степень окисления Сульфура низшая и равна -2, внешний энергетический уровень Сульфура завершенный, и он может только отдавать электроны. Таким образом, Сульфур со степенью окисления -2 может быть только восстановителем:

Высшая степень окисления Сульфура равна +6, которую он проявляет, например, в сульфатной кислоте. Концентрированная сульфатная кислота может окислять много веществ, и окислительные свойства в этих случаях проявляет именно Сульфур, который в степени окисления +6 отдал все электроны с внешнего энергетического
уровня и теперь может только их присоединять, т. е. быть только окислителем:

В промежуточных степенях окисления — 0 (в сере) и +4 (например, в SO2) — атом Сульфура может как присоединять, так и отдавать электроны, проявляя как окислительные, так и восстановительные свойства. Он может восстанавливаться или окисляться до различных степеней окисления, что проиллюстрировано на схеме:

Например, при взаимодействии серы с водородом Сульфур проявляет окислительные свойства, а при взаимодействии с кислородом — восстановительные:

Таким образом, химический элемент в зависимости от степени окисления, которую он проявляет в том или ином соединении, может быть как окислителем, так и восстановителем. Для определения возможности вступать в те или иные реакции необходимо сравнить степень окисления элемента в данном соединении со степенями окисления, которые может проявлять элемент, основываясь на строении его электронной оболочки.
Окислительные свойства наиболее выражены у типичных неметаллов (галогены, кислород, сера), а также у некоторых сложных веществ, содержащих элементы в высоких степенях окисления (+5 . +7).
Кислород 02 — самый распространенный на Земле окислитель. Он способен окислять многие простые и сложные вещества, образуя оксиды. Эти реакции сопровождаются выделением большого количества теплоты. При этом сам кислород восстанавливается до низшей степени окисления:

Самый сильный окислитель среди простых веществ — фтор F2. При обычных условиях он реагирует с большинством веществ, а при нагревании окисляет и благородные металлы — золото и платину. В атмосфере фтора горит даже вода. Фтор не может быть восстановителем, т. к. Флуор не имеет положительной степени окисления.
Концентрированная сульфатная кислота H2S04 — сильный окислитель благодаря Сульфуру. Чаще всего в реакциях он восстанавливается до степени окисления +4, образуя сульфур(1У) оксид S02. Разбавленная сульфатная кислота — слабый окислитель, поскольку в этом случае окислителем является ион Гидрогена Н + .
Нитратная кислота HN03 — сильный окислитель благодаря Нитрогену. В реакциях он восстанавливается до разных степеней окисления от +4 до -3. Смесь концентрированных нитратной и хлоридной кислот («царская вода») реагирует даже с золотом и платиной:


Калий перманганат KMnO4 — один из важнейших реагентов в химических лабораториях. Он проявляет сильные окислительные свойства благодаря Мангану. Его используют как окислитель в органическом синтезе, химическом анализе, для получения кислорода в лабораториях. Применяют в медицине как антисептическое средство.
Калий дихромат K2Cr2O7 — ценный окислитель, который используют для производства красителей, дубления кожи, в пиротехнике, живописи. Его смесь с концентрированной сульфатной кислотой (хромпик) используют для мытья стеклянной лабораторной посуды, чтобы избавиться от незаметных пятен.
Гидроген пероксид H2O2 — распространенный в химических лабораториях реагент. В нем Оксиген проявляет степень окисления -1, которая является для него промежуточной, следовательно, гидроген пероксид можно использовать и как окислитель, и как восстановитель.
Распространенные вещества — восстановители
Восстановительные свойства характерны для многих простых веществ (металлы и некоторые неметаллы (водород, углерод)), а также для соединений неметаллических элементов в низших степенях окисления

Самым распространенным восстановителем в промышленности является углерод, а именно кокс, который добывают специальной обработкой угля. Кокс используют для восстановления металлов из оксидов:

Водород H2 — распространенный восстановитель. Его также используют для восстановления металлов:

Из-за огнеопасности водород не так распространен в промышленности, как кокс, но в реакциях с водородом получают металлы значительно высшего качества (чистые).
Металлы — типичные восстановители, причем чем левее расположен металл в ряду активности, тем сильнее его восстановительные свойства. Некоторые металлы применяют в промышленности для восстановления других металлов из оксидов:

Химические элементы в высшей степени окисления могут проявлять только окислительные свойства, в низшей степени — только восстановительные свойства. Если элемент находится в промежуточной степени окисления, он может быть как окислителем, так и восстановителем.
184. В какой степени окисления элементы могут проявлять свойства: а) только окислительные; б) только восстановительные; в) и окислительные, и восстановительные? Ответ поясните.
185. Приведите примеры веществ, проявляющих сильные окислительные и восстановительные свойства. Поясните свой выбор.
186. Как зависит активность атомов элемента в окислительно-восстановительных реакциях от его степени окисления?
Задания для усвоения материала
187. Может ли проявлять восстановительные свойства: а) атом Флуора; б) флуорид-ион; в) атом Натрия; г) ион Натрия? Ответ поясните.
188. Почему фтор и кислород в химических реакциях являются преимущественно окислителями? Существуют ли еще простые вещества, которые были бы только окислителями или только восстановителями?
189. В каждом ряду веществ найдите элемент, содержащийся во всех трех веществах. Определите его степень окисления в этих соединениях. По степени окисления определите, в каком веществе этот элемент может быть только окислителем, в каком — только восстановителем, а в каком — проявлять как окислительные, так и восстановительные свойства.

190. Составьте уравнения реакций горения в кислороде приведенных веществ и определите элемент-восстановитель.
Железо, водород, фосфор, сероводород, карбон(П) оксид, метан CH4.
191. Составьте уравнение горения кальция в кислороде. Атомы какого вещества отдают электроны, а какого — принимают?
192. Составьте уравнения реакций восстановления водородом следующих веществ: вольфрам^!) оксид, хром(Ш) оксид, титан(^) оксид. В каждой реакции определите элемент-окислитель.
193. Железо можно получить восстановлением феррум(Ш) оксида углеродом, водородом, алюминием. Составьте соответствующие уравнения реакций. Назовите окислитель и восстановитель в каждой реакции.
194. В алюминий бромиде Алюминий находится в высшей степени окисления, а Бром — в низшей. Какой элемент в этом соединении может быть окислителем, а какой — восстановителем? Ответ поясните, используя уравнения реакций: А1Вг3 + 3Na = 3NaBr + Al; 2А1Вг3 + 3Cl2 = 2AlCl3 + 3Br2.
195. Несколько веков назад картины писали красками, содержащими свинцовые белила. За многие годы такие картины почернели из-за превращения белил в плюмбум(И) сульфид черного цвета. При реставрации картин их обрабатывают раствором гидроген пероксида, благодаря чему черный плюмбум(П) сульфид окисляется до белого вещества, в котором Сульфур проявляет степень окисления +6.
В какое соединение превращается плюмбум(П) сульфид? Составьте уравнение этой реакции. Как вы считаете, можно ли гидроген пероксид использовать для отбеливания серебряных изделий, которые темнеют из-за покрытия аргентум(1) сульфидом?
196. В каком воздухе быстрее потускнеет серебро: в чистом или загрязненном? Составьте план эксперимента, который мог бы доказать ваше мнение.
197. В дополнительных источниках найдите информацию об использовании окислительно-восстановительных процессов в быту и промышленности.
Источник: mozok.click