Органическая еда, только натуральные ингредиенты, никаких пестицидов! Маркетологи день за днем придумывают новые уловки и трубят на каждом углу о полезности и идеальном вкусе новинок пищевого рынка. Но есть ли от органических продуктов хоть какой-то прок для здоровья и экологии? Разбираемся с автором телеграм-канала Foodhttps://knife.media/organic-food/» target=»_blank»]knife.media[/mask_link]
Золотое извлечение
Золотое извлечение или восстановление после его руд могут потребовать, чтобы комбинация дробления, минеральной обработки, гидрометаллургической, и процессы pyrometallurgical, была выполнена на руде.
Добыча золота от руд аллювия была когда-то достигнута методами, связанными с золотым прииском, добывающим, такими как простая золотая промывка в лотке и шлюзование, приводящее к прямому восстановлению маленьких золотых самородков и хлопьев. Методы горной промышленности золотого прииска начиная с середины к концу 20-го века вообще только были практикой шахтеров ремесленника. Гидравлическая горная промышленность использовалась широко в калифорнийской золотой лихорадке и связала разрушение аллювиальных депозитов со струями воды с высоким давлением. Руды хард-рока сформировали основание большинства коммерческих золотых операций по восстановлению с середины 20-го века, где открытая яма и или методы горной промышленности недр используется.
Этот парень превратил клубнику в золото
Как только руда добыта, ее можно рассматривать в целом руда, используя выщелачивание свалки или процессы выщелачивания кучи. Это типично для низкосортных, окисных депозитов. Обычно, руда сокрушена и собрана до выщелачивания кучи. Руды высокого качества и руды, стойкие к выщелачиванию цианида в грубых размерах частицы, потребуйте последующей обработки, чтобы возвратить золотые ценности. Методы обработки могут включать размол, концентрацию, жарку и окисление давления до cyanidation.
История
Плавление золота начало когда-то приблизительно 6 000 — 3000 до н.э. Согласно одному источнику техника начала использоваться в Месопотамии или Сирии. В древней Греции Гераклит написал на предмете.
Согласно де Лесерде и Сэломонсу (1997) ртуть сначала использовалась для извлечения в приблизительно 1 000 до н.э, согласно Meech и другим (1998), ртуть использовалась в получении золота до последнего периода первых тысячелетий.
Техника, известная Плини Старший, была извлечением посредством сокрушительного, мытьем и затем применением высокой температуры, с проистекающим порошкообразным материалом.
Промышленная эра
Растворимость золота в растворе воды и цианида была обнаружена в 1783 Карлом Вильгельмом Шееле, но только в конце 19-го века, производственный процесс был развит. Расширение добычи золота в Рэнде Южной Африки начало замедляться в 1880-х, когда новые находимые депозиты имели тенденцию быть pyritic рудой. Золото не могло быть извлечено из этого состава ни с одним из тогдашних доступных химических процессов или технологий.
В 1887 Джон Стюарт Макартур, работающий в сотрудничестве с братьями доктор Роберт и доктор Уильям Форрест для Tennant Company в Глазго, Шотландия, развил Процесс Макартура-Форреста для добычи золотых руд. Приостанавливая сокрушенную руду в растворе цианида, разделение 96-процентного чистого золота было достигнуто.
Золото и пара советов…GOLDEN CHANNEL…
Процесс сначала использовался на Рэнде в 1890, приводя к буму инвестиций, поскольку более крупные золотые рудники были открыты. В 1896 Бодлэндер подтвердил, что кислород был необходим для процесса, что-то, что было подвергнуто сомнению Макартуром и обнаружило, что перекись водорода была сформирована как промежуточное звено.
Метод, известный как ‘выщелачивание кучи’, был сначала предложен в 1969 Горным управлением США и использовался к 1970-м.
Типы руды
Золото происходит преимущественно как родной металл, обычно сплавляемый до большей или меньшей степени с серебром (как электрум), или иногда с ртутью (как смесь). Родное золото может произойти как большие самородки как мелкие зерна или хлопья в аллювиальных депозитах, или как зерно или микроскопические частицы, включенные в другие скалы.
Руды, в которых золото происходит в химическом составе с другими элементами, сравнительно редки. Они включают calaverite, sylvanite, nagyagite, petzite и krennerite.
Концентрация
Концентрация силы тяжести была исторически самым важным способом извлечь родные металлические кастрюли использования или мытье столов. Объединение с ртутью использовалось, чтобы увеличить восстановление, часто добавляя его непосредственно к столам канавки, и ртуть все еще широко используется в маленьком diggings во всем мире.
Однако процессы плавания пены могут также использоваться, чтобы сконцентрировать золото. В некоторых случаях особенно когда золото присутствует в руде как дискретные грубые частицы, концентрат силы тяжести может быть непосредственно smelted, чтобы сформировать золотые слитки. В других случаях, особенно когда золото присутствует в руде как мелкие частицы или не достаточно освобождено от вмещающей породы, концентраты рассматривают с солями цианида, процесс, известный как cyanidation выщелачивание, сопровождаемое восстановлением после решения для рапы. Восстановление после решения, как правило, включает адсорбцию на активированном угле, сопровождаемом концентрацией решения или демонтажом и или электролиз.
Плавание пены обычно применяется, когда золото, существующее в руде, тесно связано с полезными ископаемыми сульфида, такими как пирит или арсенопирит, и когда такие сульфиды присутствуют в больших количествах в руде. В этом случае концентрация сульфидов приводит к концентрации золотых ценностей. Обычно восстановление золота от концентратов сульфида требует последующей обработки, обычно жарясь или влажного окисления давления. Эти pyrometallurgical или гидрометаллургическое лечение самостоятельно обычно сопровождаются cyanidation и углеродными адсорбционными методами для заключительного восстановления золота.
Иногда золото присутствует как незначительный элемент в основном компоненте сплава (например, медь) концентрат и восстановлено как побочный продукт во время производства основного компонента сплава. Например, это может быть восстановлено в слизи анода во время процесса electrorefining.
Выщелачивание
Если золото не может быть сконцентрировано для плавления, то это выщелочено водным раствором:
- Процесс цианида — промышленный стандарт.
- Тиосернокислое выщелачивание, как доказывали, было эффективным на рудах с высокими разрешимыми медными ценностями или рудах, которые испытывают preg-ограбление: поглощение каменноугольными компонентами, которое предпочтительно поглощает комплексы золота и золотого цианида.
Выщелачивание, Оптовая рапа, извлекаемое золото или ПИШЕТ ПОСТ С ВОПРОСОМ, является также процессом, который используется, чтобы проверить область на золотые концентрации, где золото может не быть немедленно видимо.
Невосприимчивые золотые процессы
«Невосприимчивая» золотая руда — руда, которая является естественно стойкой к восстановлению по стандарту cyanidation и углеродным адсорбционным процессам. Эти невосприимчивые руды требуют, чтобы предварительная обработка для cyanidation была эффективной при восстановлении золота. Невосприимчивая руда обычно содержит полезные ископаемые сульфида, органический углерод или обоих.
Полезные ископаемые сульфида часто заманивают в ловушку или закрывают золотые частицы, мешающие решению для рапы комплекса с золотом. Органический углерод, существующий в золотой руде, может адсорбировать расторгнутые комплексы золотого цианида почти таким же способом как активированный уголь. Этот так называемый углерод «preg-ограбления» смыт, потому что это значительно более прекрасно, чем углеродные экраны восстановления, как правило, раньше возвращали активированный уголь.
Возможности предварительной обработки для невосприимчивых руд включают:
- Жарка
- Биоокисление
- Окисление давления
- Сверхтонкий размол
Невосприимчивым процессам переработки руды может предшествовать концентрация (обычно плавание сульфида). Жарка используется, чтобы окислить и серу и органический углерод при высоких температурах, используя воздух и/или кислород. Биоокисление включает использование бактерий, которые способствуют реакциям окисления в водной окружающей среде. Окисление давления — водный процесс для удаления серы, выполненного в непрерывном автоклаве, работающем в высоком давлении и несколько повышенных температурах. Сверхчеткий размол может использоваться, когда освобождение золотых частиц от окружающей минеральной матрицы — основная невосприимчивая особенность руды.
Золотое плавление
Удаление Меркурия
Меркурий — опасность для здоровья, особенно когда в газовой форме.
Чтобы удалить эту опасность, перед плавлением, золото ускоряет от электролиза, или процессы Меррилла-Кроу обычно нагреваются в возражении, чтобы возвратить любую существующую ртуть, который иначе вызвал бы проблемы со здоровьем и проблемы охраны окружающей среды из-за ее выпуска (улетучивание) во время плавления.
Существующая ртуть обычно не от ртутного процесса объединения, который больше не используется формальными золотодобывающими компаниями, но от ртути в руде, которая следовала за золотом посредством процессов выщелачивания и осаждения.
Если есть высокие уровни меди или существующего серебра, выщелачивание поспешных использующих азотных или серных кислот может требоваться.
Железный демонтаж
Во время плавления железо может быть окислено, используя nitre. Злоупотребление nitre разъест горшок плавления, увеличивая оба затрат на обслуживание и риск катастрофических утечек (известный как беглецы или отверстия в горшке, через который литое обвинение потеряно).
Золото, очищающееся и отделяющееся
Золотое разделение — прежде всего удаление серебра от золота и поэтому увеличения чистоты золота. Разделение золота от серебра было сделано с древних времен, начинающихся в Лидии в 6-м веке до н.э. Были осуществлены различные методы; соленое цементирование с древних времен, отделяя использование дистиллированных минеральных кислот со средневековых времен, и в современные времена, используя хлоризацию, используя процесс Миллера и электролиз, используя процесс Wohlwill.
См. также
- Золото землеройной машины
- Добыча золота
- Происхождение руды
- Оптовая рапа извлекаемое золото
Источник: ru.knowledgr.com
Химия органозолота
Химия органозолота — это исследование соединений, содержащих связи золото — углерод. Они изучаются в академических исследованиях, но в остальном не получили широкого распространения. Доминирующими степенями окисления для золотоорганических соединений являются I с координационным числом 2 и линейной молекулярной геометрией и III с CN = 4 и квадратной плоской молекулой. геометрия. Первым обнаруженным золотоорганическим соединением был карбид золота (I) Au 2C2, который был впервые получен в 1900 году.
Золото (I)
Комплексы золота (I) являются двухкоординатными, линейный, диамагнитный, 14 видов электронов. Обычно они существуют в виде аддуктов LAuR с лигандом L, например трифенилфосфином или изоцианидом. Лиганд предотвращает восстановление Au (I) до металлического Au (0) при димеризации органического остатка.
Золото (I) также может существовать в виде аурата M [AuR 2 ] (комплекс ), посредством чего катион обычно снабжен комплексообразующим агентом для улучшения стабильность. Анион AuR 2 также является линейным, как и другие частицы M (d), такие как Hg (Me) 2 и Pd (Me) 2. Известно, что золото образует ацетилиды (способные образовывать полимерные структуры), карбены и карбины. Классическим методом получения соединений LAuR является реакция реактива Гриньяра с галогенидом золота (I). Последующая реакция с литийорганическим R-Li образует комплекс ата.
В особой группе соединений атом углерода арил действует как мостик между двумя атомами золота. Одно такое соединение, (MesAu) 5, образуется в результате реакции между Au (CO) Cl и мезитил Гриньяра. Углерод может координироваться с золотом до значения 6. Соединения типа C (AuL) 4 изолобальны с метаном, а соединения типа C (AuL) 5 изолобален с ионом метания. Эти сверхкоординированные кластеры золотоорганического соединения часто стабилизируются за счет аурофильных взаимодействий между формально закрытыми золотыми центрами.

Некоторые типичные частицы органозолота с различными типами связывания.
Золото (III)
Комплексы золота (III) являются 4-х координатный, квадратный плоский, диамагнитный, токсичный, 16 видов электронов. Когда формальное координационное число меньше 4, лиганды, такие как хлор, могут восполнить его, образуя мостиковый лиганд. Еще одна стратегия — внутримолекулярное хелатирование. В целом соединения золота (III) токсичны и поэтому менее изучены, чем золото (I).
Комплексы моноарилзолота (III) представляют собой один хорошо изученный класс комплексов. Их часто получают путем прямого электрофильного аурирования аренов AuCl 3. Гомолептические тетраалкилауратные (III) комплексы (например, Li [AuMe 4 ]) также хорошо охарактеризованы.
Катализ золотом
Общие соображения
Золото- катализируемые реакции делятся на две основные категории: гетерогенный катализ, включая катализаторы на основе наночастиц золота (например, Au / TiO 2) и поверхности тиол-монослоя золота и катализаторы на носителе из оксида алюминия, включая Au / CeO 2 на носителе из оксида алюминия. Эти катализаторы были исследованы для важных в промышленном отношении процессов, таких как окисление спиртов, окисление монооксида углерода (CO) и различных реакций селективного гидрирования (например, от бутадиена до бутена). Хотя они часто эффективны и демонстрируют полезную или уникальную селективность, существует значительная неопределенность в отношении механизма процессов, катализируемых различными гетерогенными золотыми катализаторами, даже по сравнению с другими гетерогенными катализаторами на основе переходных металлов.
Напротив, гомогенный катализ с золотом использует простые или связанные с лигандами соединения золота (I) или золота (III), которые растворимы в органических растворителях и используются для синтеза тонких химикатов. неорганическая химия. Бинарные галогениды золота и простые комплексы, включая хлорид золота (I), хлорид золота (III) и хлористоводородную кислоту, использовали в качестве комплексов.
Эти источники золота, однако, быстро приводят к появлению плохо определенных и легко дезактивируемых (за счет восстановления до Au) активных катализаторов в растворе. Разработка четко определенных фосфин- или NHC-лигированных комплексов золота (I) была важным достижением и привела к значительному увеличению интереса к синтетическим применениям золотого катализа. Лигированные комплексы золота (I) обычно получают и хранят в виде стабильных (но не вступающих в реакцию) хлоридов, LAuCl, например, хлор (трифенилфосфин) золота (I), которые обычно активируются путем отщепления галогенидов серебром. соли, такие как AgOTf, AgBF 4 или AgSbF 6, для образования катионных частиц золота (I). Несмотря на то, координационно ненасыщенный комплекс «Lau» является умозрительно генерируются из смеси LAuCl / AgX, точного характера катионных частиц золота и роли соли серебра остается несколько спорной. Пара-нитробензоат, бистрифлимид и некоторые нитрильные комплексы представляют собой каталитически активные, но не содержащие серебра предварительные катализаторы.
Катионное золото (I) образует π-комплексы со связями алкен или алкин в соответствии с моделью Дьюара – Чатта – Дункансона. Золото, безусловно, не единственный металл, демонстрирующий такой тип связи и реакционной способности, некоторые ионы металлов , изолобальные с простым протоном (т. Е. С пустой s-орбиталью), также делают это: например, ртуть (II) и платина (II). Электрофильные ионы и подобные комплексы с сильной склонностью к образованию π-комплексов обычно известны как пи (π) -кисл (см. Также: взаимодействие катион-пи ).
Золото (I) -алкеновые и -алкиновые комплексы являются электрофильными и восприимчивыми к нуклеофильной атаке. При оксимеркурации образующиеся в результате ртутьорганические соединения образуются стехиометрически и требуют дополнительной стадии для высвобождения продукта. золота, протонолиз связи Au-C замыкает каталитический цикл, позволяя координировать другой субстрат. Некоторые практические преимущества катализа золотом (I) включают: 1) стабильность на воздухе (из-за высокого окислительного потенциала Au (I)), 2) толерантность к посторонней влаге (из-за ее низкой оксофильности) и 3) относительно низкая токсичность по сравнению с другими пи-кислотами (например, Pt (II) и Hg (II)). Химически комплексы Au (I) обычно не подвергаются окислению до более высоких степеней окисления, а Au (I) -алкилы и -винилы не подвержены элиминированию β-гидрида.

Типичный механизм катализируемой золотом (I) гидрофункционализации алкинов и алленов.
Историческое развитие
В 1976 году Томас и его коллеги сообщили о преобразовании фенилацетилена в ацетофенон с использованием тетрахлорозавриновой кислоты в Доходность 37%. В этой реакции золото (III) использовалось в качестве гомогенного катализатора, заменяющего ртуть в оксимеркурации. В этом же исследовании указан опубликованный выход>150%, что указывает на катализ, который, возможно, не был признан химиками.
В 1991 году Утимото вступил в реакцию золота (III) (NaAuCl 4) с алкинами и водой. Телес выявил главный недостаток этого метода, поскольку Au (III) быстро восстанавливается до каталитически мертвого металлического золота, и в 1998 году вернулся к теме Au (I) на лигандной основе для того же превращения:
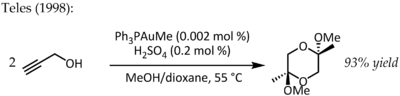
Эта конкретная реакция продемонстрировала фантастическую каталитическую эффективность и вызовет шквал исследований по использованию комплексов фосфинзолота (I) для активации множественных связей CC в ближайшие годы. Несмотря на более низкую стабильность комплексов золота (III) в каталитических условиях, в некоторых случаях также было обнаружено, что простой AuCl 3 является эффективным катализатором. Например, Хашми сообщил о катализируемой AuCl 3 реакции алкина / фурана реакции Дильса-Альдера — типе циклоприсоединения, которое обычно не происходит, — для синтеза 2,3-Дизамещенные фенолы :

Дальнейшие механистические исследования пришли к выводу, что это не согласованное превращение, а скорее начальное гидроарилирование алкина, за которым следует серия неочевидных внутримолекулярных перегруппировок, завершающихся электроциклизацией и реоматизацией 6π.
Релятивистские эффекты важны в химии золотоорганических соединений из-за большого ядерного заряда металла (Z = 79). Как следствие релятивистски расширенных 5d-орбиталей, фрагмент LAu может стабилизировать соседний карбокатион через донорство электронов на пустую орбиталь p-типа. Таким образом, в дополнение к их ожидаемой реакционной способности, подобной карбокатиону, эти катионы также проявляют значительный карбеновый характер, свойство, которое использовалось в каталитических превращениях, таких как циклопропанирование и внедрение C-H. Сложные эфиры пропаргила могут служить предшественниками катионных промежуточных соединений золото-винилкарбен, которые могут взаимодействовать с алкенами согласованным образом с образованием продукта циклопропанирования. Использование хирального лиганда ((R) -DTBM-SEGPHOS ) привело к хорошим или превосходным уровням энантиоселективности.
![]()

Хотя Эчаваррен впервые сообщил о получении хиральных комплексов бисфосфиндиголда (I) для энантиоселективного катализа золотом протекающий через типичный механизм пи-активации, ранний атипичный пример энантиоселективного катализа золотом был описан Хаяши и Ито в 1986 году. В этом процессе бензальдегид подвергается циклизации в присутствии хиральный ферроценилфосфиновый лиганд и комплекс бис (изоцианид) золота (I) с образованием хирального оксазолина. Поскольку оксазолины могут быть гидролизованы с образованием 1,2-аминоспирта, эта реакция представляет собой первый пример каталитической, асимметричной альдольной реакции.
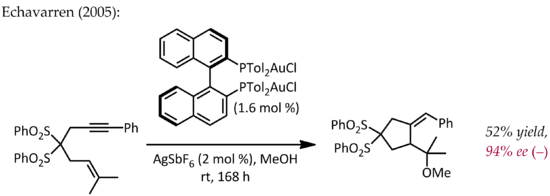
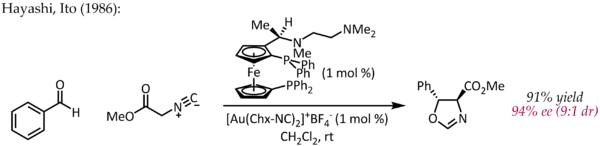
В отличие от других реакций, описанных выше, эта реакция не включает активацию двойной или тройной связи CC золотом. В простой механистической картине золото (I) одновременно координируется с двумя фосфиновыми лигандами и изоцианатной группой углерода, которая затем подвергается атаке карбонильной группы. Дальнейшие исследования способа связывания Au (I) показывают, что эту простую картину, возможно, придется пересмотреть.
Гетерогенный катализ золотом — древняя наука. Золото является привлекательным металлом для использования из-за его устойчивости к окислению и разнообразия морфологии, например, материалов с кластером золота . Было показано, что золото эффективно при низкотемпературном окислении CO и гидрохлорировании ацетилена до винилхлоридов. Точная природа каталитического центра в этом типе процесса обсуждается. Представление о том, что золото может катализировать реакцию, не означает, что это единственный способ. Однако другие металлы могут выполнять ту же работу с меньшими затратами, особенно в последние годы железо (см. химия железоорганических соединений ).
Хотя не имеет коммерческого значения, золото катализирует многие органические превращения, обычно образование углерод-углеродной связи из Au (I) и образование связи CX (X = O, N) из состояния Au (III) из-за более жесткой кислотности Льюиса этого иона. В течение последнего десятилетия несколько исследований продемонстрировали, что золото может эффективно катализировать реакции кросс-сочетания C-C и C-гетероатомов, которые протекают через цикл Au (I) / Au (III). Хонг С. Шен суммировал гомогенные реакции с образованием циклических соединений по 4 основным категориям:
- гетероатом нуклеофильное присоединение к ненасыщенным связям CC, особенно с образованием небольших гетероциклов (фураны, пирролы, тиофены)
- Гидроарилирование: в основном реакция Фриделя-Крафтса с использованием комплексов металл-алкин. Пример, реакция мезитилена с фенилацетиленом :

- циклизацией енина, в частности циклоизомеризацией, одним из первых примеров является циклоизомеризация 5-экзо-диг 1,6 енина:
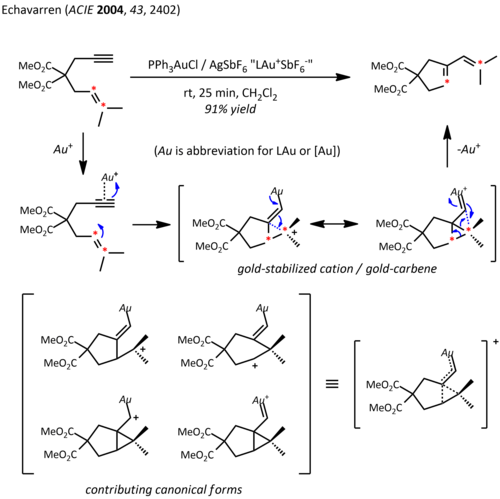
- реакции циклоприсоединения с ранним примером циклоприсоединения оксида нитрила с алкином.
Другими реакциями являются использование золота в активации связи C – H и альдола реакции. Золото также катализирует реакции сочетания.
Ограничения
Хотя катализируемая золотом гидрофункционализация алкинов, алленов и аллиловых спиртов легко происходит в сравнительно мягких условиях, неактивированный алкен остается плохим субстратом в большинстве случаев, в значительной степени из-за устойчивости промежуточных комплексов алкилзолота (I) к протодеаурации. Развитие межмолекулярных превращений, катализируемых золотом, также отстает от развития внутримолекулярных.
Источник: alphapedia.ru