На внешнем энергетическом уровне у серы 6 электронов, из которых 2 неспаренных на p-орбиталях:

До устойчивой электронной конфигурации сере не хватает двух электронов, поэтому между двумя атомами серы образуется две общие пары электронов (двойная связь):

Структурная формула: S=S
Такая связь является ковалентной неполярной.
K2O
Калий – это элемент IA группы 4-го периода с одним электроном на внешнем энергетическом уровне. Ему проще всего отдать электрон, чем принимать чужие.
Кислород – это элемент VIA группы 2-го периода с шестью электронами на внешнем энергетическом уровне. Для завершения уровня ему не хватает всего 2 электрона. Поэтому кислород – активный неметалл с высокой окислительной способностью.
БЕЗУМНЫЙ лайфхак по Химии — Как определить Тип Химической Связи
Схема образования ионной связи:

H2S
Электронная формула водорода 1s 1 и, казалось бы, ему легко отдать электрон. Однако не будем забывать, что водород находится в первом периоде, где всего 1 энергетический уровень, способный принять лишь 2 электрона. Таким образом, до завершения энергетического уровня водороду не хватает также одного электрона. Это объясняет высокую электроотрицательность водорода (ОЭО = 2,1) по сравнению с щелочными металлами. Тем не менее ОЭО серы выше (2,58) поэтому связь будет ковалентно полярная.
Электронная формула серы 1s 2 2s 2 2p 6 3s 2 3p 4
Сере до завершения энергетического уровня не хватает двух электронов, поэтому она соединяется с двумя атомами водорода:

Структурная формула H-S-H, связь ковалентная полярная.
N2
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s 2 2s 2 2p 3
Между атомами азота образуется три общие электронные пары (тройная связь):

Эта связь ковалентная неполярная.
Li3N
Литий – это элемент IA группы 2-го периода с одним электроном на внешнем энергетическом уровне. Относительно легко отдаёт электрон.
Электронная формула лития 1s 2 2s 1
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 класс
Электронная формула азота 1s 2 2s 2 2p 3
Схема образования ионной связи:

Cl3N
Хлор имеет семь электронов на внешнем энергетическом уровне и до устойчивой электронной конфигурации ему не хватает всего одного электрона.
Электронная формула 1s 2 2s 2 2p 6 3s 2 3p 7
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s 2 2s 2 2p 3
Относительная электроотрицательность хлора 2,83, азота 3,07 поэтому связь будет ковалентная полярная.
Схема образования связи:
Источник: himgdz.ru
Презентация, доклад по химии Золото
ЗолотоЗо́лото — элемент 11 группы,шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 79. Обозначается символом Au (лат. Aurum). Простое вещество золото — благородный металл жёлтого цвета.
- Главная
- Химия
- Презентация по химии Золото
Слайд 1Золото

Слайд 2Золото
Зо́лото — элемент 11 группы,шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 79.
Обозначается
символом Au (лат. Aurum). Простое вещество золото — благородный металл жёлтого цвета.

Слайд 3Происхождение названия
Праславянское «*zolto» («золото»)
родственно лит. geltonas «жёлтый»,
латыш. zelts «золото»;
нем. gold, англ. Gold.
Отсюда же названия цветов: «жёлтый», «зелёный».
Латинское
aurum означает «жёлтое» и родственно с «Авророй» (Aurora) — утренней зарёй.

Слайд 4 Чистое
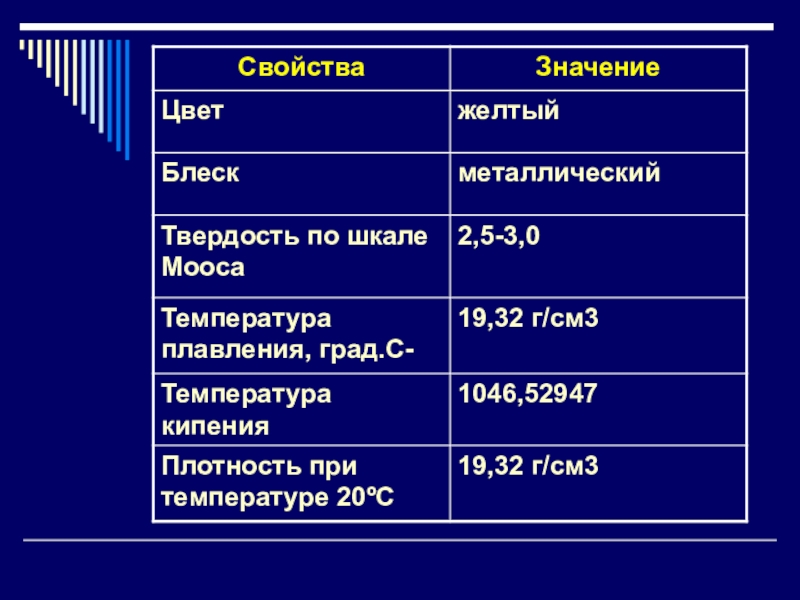
золото — мягкий металл жёлтого цвета.
В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким сопротивлением.
Золото – очень тяжелый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Литровая бутыль, заполненная золотым песком, весит приблизительно 16 кг. Золото очень ковко и тягуче. Из кусочка золота весом в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0,0001 мм). Мягкость чистого золота настолько велика, что его можно царапать ногтем.

Слайд 5
Слайд 6
Золото — самый инертный металл, стоящий в
ряду напряжений правее всех других металлов, благодаря чему было отнесено к благородным металлам.
ЗОЛОТО:
1. Не взаимодействует с кислородом, азотом, водородом, фосфором, сурьмой и углеродом.
2. Галогены с золотом при нагревании образуют
соединения: AuF3, AuCl3, AuBr3 и AuI. Особенно легко, уже при комнатной температуре, идет реакция с хлорной и бромной водой.
В быту опасность для золотых колец представляет иодная настойка – водно-спиртовый раствор иода и иодида калия:
2Au + I2 + 2KI = 2K[AuI2].

Слайд 7
3.Единственные кислоты, которые
взаимодействуют с золотом – это селеновая,
хлороводородная и с царской водкой:
– селеновая – 2Au + 6HSeO4=Au2(SeO4) + 3H2SeO3 + 3H2O
– хлорная – 2Au + 3Cl2 + 2HCl=2H[AuCl4]
– «царская водка» – Au + HNO3 + 4HCl = H[AuCl4] + NO +H2O
Соединения золота неустойчивы и в водных растворах гидролизуются, легко восстанавливаясь до металла.
Заряд ионов золота в растворе всегда отрицательный.
4.Действуют на золото и расплавы из смеси щелочей и нитратов щелочных металлов: 2Au + 2NaOH + 3NaNO3 = 2Na[AuO2] + 2Na2O
5.Пероксиды натрия или бария: 2Au + 3BaO2 = Ba[AuO2]2 + 3BaO
И многое другое…

Слайд 8 Предполагается,
что золото и другие элементы
тяжелее железа образовались в результате
разрушения нейтронных звёзд. По этой теории в результате взрыва нейтронной звезды содержащая металлы пыль (в том числе золото) выбрасывается в космическое пространство, в котором оно впоследствии конденсируется, так произошло и в Солнечной системе и на Земле. Поскольку Земля была в расплавленном состоянии, когда она была только что создана, почти всё золото в настоящее время на Земле находится в ядре. Большинство золота, которое сегодня присутствует в земной коре и мантии, было доставлено на Землю астероидами во время поздней тяжелой бомбардировки.
На Земле золото находится в рудах в породах, образованных начиная с докембрийского периода.

Слайд 9Нахождение в природе
Содержание в земной коре 4,3·10-7% по массе,
в воде морей и океанов менее 5·10-6% мг/л.
Современные методы химического анализа позволяют обнаружить присутствие ничтожных количеств Au в организмах растений и животных, в винах и коньяках, в минеральных водах и в морской воде.
В природе в чистом виде золото почти не встречается, но не редки случаи самородного золота, в котором в качестве примеси содержатся медь (до 20%), палладий (от 5 до 11%), висмут (до 4%). В большинстве случаев оно содержит в виде примеси серебро (от 4 до 15%).

Слайд 10Золото в экономике
ЗОЛОТО, в экономике — драгоценный металл; естественные
свойства золота — однородность, делимость, сохраняемость, портативность (большая стоимость при небольшом объеме и массе) — делали его на протяжении длительных исторических периодов наиболее подходящим для роли всеобщего эквивалента, т. е. денег.

Слайд 11
Наибольшей популярностью сегодня (впрочем, как
и всегда) пользуются операции с золотом, которые составляют 90-95% от общей суммы операций с металлами.
Несмотря на сложившийся стереотип о том, что в банковские металлы инвестируют лишь для того, чтобы уберечь свои сбережения от обесценивания, данный вид вложения способен принести доход, причем немалый.
Цена на металлы уже несколько лет
подряд растет с завидным посто-
янством. Так, за последние пять лет
золото на международном рынке
подорожало на 54,4%

Слайд 12 Имеющееся в настоящее
время в мире золото распределено так: около 10 % — в промышленных изделиях, остальное делится приблизительно поровну между централизованными запасами (в основном, в виде стандартных слитков химически чистого золота), собственностью частных лиц в виде слитков и ювелирными изделиями.
В промышленности
Золото незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия используются очень широко.
Тонкий слой золота (20 нм) на внутренней поверхности оконных и витражных стекол существенно уменьшает нежелательные тепловые потери зимой, а летом предохраняет внутренние помещения зданий и транспортных средств от нагревания инфракрасными лучами

Слайд 13 Золото используется
в качестве покрытия зеркал,
работающих в дальнем инфракрасном диапазоне, в
качестве специальной оболочки в нейтронной бомбе.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов.
Золочение металлов широко используется в качестве метода защиты от коррозии.
В стоматологии.
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком.
В формакологии.
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза, ревматоидных артритов и т. д.). Радиоактивный изотоп 198Au (период полураспада 2,967 сут.) используется при лечении злокачественных опухолей в радиотерапии.

Слайд 14

Слайд 15Цвета золота
Красное золото – серебро, медь
Желтое золото – серебро, медь
(в другом процентном соотношении)
Белое золото – палладий, никель, платина
Источник: shareslide.ru
Типы химических связей

Химия
Автор Марина Андреева На чтение 7 мин Просмотров 17.3к. Опубликовано 25 апреля, 2019
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами. Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
Типы химических связей
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная связь
Ковалентная неполярная связь
Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.
Рассмотри образование ковалентной неполярной связи, на примере водорода:
![]()
Ковалентная полярная связь
Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
![]()
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из элементов отдает свои электроны и он заряжается положительно. Элемент, который принимает электроны заряжается отрицательно.
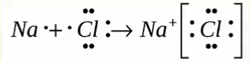
Металлическая связь
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С2Н6О).
Примеры решения задач по химии в ЕГЭ на типы химических связей
Задача 1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
Решение: Ионная химическая связь характерна для оксидов, гидроксидов и солей металлов (+соли аммония и гидроксид аммония). Соли —это вариант 1 и 3.
Задача 2. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная связь характерна для простых веществ-неметаллов и соединений типа неметалл-неметалл. Это простое вещество хлор и сульфид углерода. Таким образом ответ будет 1 и 2.
Задача 3. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
Решение: Ковалентная полярная связь образуется между двумя разными неметаллами. Ответ 34.
Задача 4. Из предложенного перечня выберите два соединения, в которых присутствует водородная химическая связь.
Решение: Водородная химическая связь возникает между молекулами воды и одноатомных спиртов. Ответ 14.
Задача 5. Из предложенного перечня выберите два соединения, в которых ковалентная связь образована по донорно-акцепторному механизму.
- Карбид кальция
- Сульфат аммония
- Оксид фосфора (V)
- Криптон
- Угарный газ
Решение: Донорно-акцепторный механизм образования связи характерен для иона аммония и угарного газа в связи с наличием неподеленной электронной пары на азоте и углероде соответственно. Ответ: 25.
Задача 6. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
Запишите в поле ответа номера выбранных соединений.
Решение: ковалентная неполярная связь образуется между одинаковыми атомами. Это фтор и кислород.
Ответ 35.
Задача 7. Из предложенного перечня выберите два вещества, с каждым из которых сера образует ионные связи.
Запишите в поле ответа номера выбранных соединений.
Решение: Ионные связи образуются между металлом и неметаллом. Сера-неметалл, значит, нужно выбрать металлы. Это натрий и кальций.
Ответ: 24.
Задача 8. Из предложенного перечня выберите два вещества, в молекулах которых имеются как полярные, так и неполярные ковалентные связи.
Решение: В молекуле под номером 1 есть 4 связи C-Cl, все они полярные, но в задании нужно найти молекулу как с полярными, так и с неполярными связями.
В молекуле бензола (под номером 2) содержится 2 вида связей: C-C неполярная и C-H полярная.
В молекуле HNO3 хоть и 3 кислорода, но между собой они не связаны, поэтому наблюдается 2 вида только полярных связей H-N, N-O.
В молекуле N2O4 2 типа связей: N-N неполярная и N-O полярная.
В молекуле углекислого газа оба кислорода связаны только с углеродом, образуя только полярные связи.
Ответ 24.
Задача 9. Из предложенного перечня выберите два вещества, в которых присутствует металлическая связь.
Решение: металлическая связь характерная для металлов и сплавов. Металлы здесь — железо и цинк. Ответ 35.
Задача 10. Из предложенного перечня выберите два вещества, с которыми соединения хлора имеют ковалентную полярную связь.
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому ковалентную полярную связь имеет соединение хлора с водородом и фосфором. С остальными — связь ионная.
Ответ: 15.
Задача 11. Из предложенного перечня выберите два соединения, в которых имеются только ионные связи.
Решение: Ковалентная не полярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ионные связи присутствуют в KI и BaCl2.
Ответ: 12.
Задача 12. Из предложенного перечня выберите два соединения, между молекулами которых образуются водородные связи.
- Фтороводород
- Бутанол
- Хлорметан
- Диметиловый эфир
- Этилен
Решение: Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы.
Среди предложенных веществ водородная связь образуется между молекулами фторводорода и бутанола.
Ответ: 12.
Задача 13. Из предложенного перечня выберите два соединения, образованные как ковалентной, так и ионной связью.
Решение: В этиловом спирте связи ковалентные, в хлориде натрия — ионные, в бензоле — ковалентные. В нитрате аммония и сульфате кальция связи в ионе аммония и нитратном и сульфатном анионах ковалентные, а между ионом аммония и нитратным анионом, а также ионом кальция и сульфат анионом — ионная.
Ответ: 13
Задача 14. Из предложенного перечня выберите два соединения, где кислород образует ковалентную полярную связь.
Решение: Ковалентная полярная связь осуществляется между разными неметаллами.
Ответ: 13
Задача 15. Из предложенного перечня выберите два типа химических связей, которые реализуются в сульфате калия.
- ковалентная неполярная
- ковалентная полярная
- ионная
- металлическая
- водородная
Решение: Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. В сульфате калия между ионами калия и сульфат-ионами связь ионная, а между кислородом и серой в сульфат-ионе — ковалентная полярная.
Ответ: 23.
Химический состав клетки
Кристаллическая решетка и типы кристаллических решеток
Степень окисления и валентность
Как решать экономические задачи — алгоритм решения экономических задач егэ по математике профильный уровень
Как решать задачи на вероятность
Источник: novstudent.ru