Связь в металлах между («атом-ионами») посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью).
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
| кубическая (1 атом на ячейку) а) | объемно-центрированная кубическая (ОЦК) (2 атома на ячейку) б) | гранецентрированная кубическая (ГЦК) (4 атома на ячейку) в) | гексагональная плотноупакованная (ГП) (6 атомов на ячейку) г) |
Рис. Основные типы кристаллических решеток металлов
Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки:
Кристаллические решетки: заучить или понять за 20 минут? | Химия ЕГЭ 2023 | Умскул
— сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована;
— валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
— металлическая связь не обладает направляемостью и насыщенностью.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Золото тип химической связи и кристаллической решетки

Опубликовано 10.06.2017 по предмету Химия от Гость >> Оцени ответ


- Алгебра

- Математика

- Русский язык

- Українська мова

- Информатика

- Геометрия

- Химия

- Физика

- Экономика

- Право

- Английский язык

- География

- Биология

- Другие предметы

- Обществознание

- История

- Литература

- Українська література

- Беларуская мова

- Қазақ тiлi

Показать ещё
Химические связи. Кристаллические решетки. Задание №4 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭ
Источник: www.shkolniku.com
Работа 1. Химическая связь. Кристаллические решетки

KCl- ионная решетка, атомная, сахар – молекулярная, йод – молекулярная, алмаз – атомная.
Вариант 2
1. Из приведенных формул веществ выпишите только формулы соединений с ковалентной полярной связью: CO₂, PH₃, H₂, OF₂, O₂, KF, NaCl.
2. Составьте электронные формулы молекул хлора Cl₂, сероводорода H₂S и фосфина PH₃.


3. На конкретных примерах сравните физические свойства веществ, имеющих молекулярную и кристаллическую решетку.

Вариант 3
1. Определите вид химической связи в соединениях SO₃, NCl₃, ClF₃, Br₂, H₂O и NaCl.

2. Составьте электронные формулы молекул йода I₂, воды и метана CH₄.

3. На конкретных примерах покажите, как зависят некоторые физические свойства веществ от типа их кристаллической решетки.

Вариант 4
1. Из приведенных формул веществ выпишите только формулы соединений с ковалентной неполярной связью: I₂, HCl, O₂, NH₃, H₂O, N₂, Cl₂, PH₃, NaNO₃.
2. Составьте формулы соединений, образованных: а) калием и хлором; б) водородом и йодом; в) кислородом и водородом. Укажите вид химической связи в этих соединениях.

3. Изобразите схемы строения ионов Li+, Cl-, Na+ и F-. Укажите тип кристаллической решетки в соединениях, образованных этими частицами.
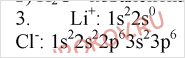

Сохраните или поделитесь с одноклассниками:
Источник: dourokovgdz.ru