Продолжаем нашу тему по химической связи и сегодня изучаем кристаллическое состояние вещества, понятия ионная связь, металлическая связь из 4 задания егэ по химии.
Итак, для понимания материала давайте возьмем с вами стакан с плоским дном и насыплем в него бусины (пусть они будут круглые) в один слой. У нас получился моноатомный слой. Кстати пусть одна бусина отличается по цвету от других. Назовем ее центральной.
Рассмотрим наше построение и сделаем первые выводы:
- Любая бусина окружена шестью другими (пусть они будут под цифрами 1-6)
- Поверхность слоя имеет неровности, возвышения и впадины. Каждая бусина – это возвышенность, между тремя любыми соприкасающимися бусинами – впадина.
- Расположение бусин в слое можно представить в виде сетки из перекрёстных линий, а в точках пересечения линий располагаются бусины. Эти точки именуются узлами сетки. Так как все ячейки нашей сетки идентичны между собой, то для описания геометрического расположения частиц в слое можно указать параметры одной ячейки. В этом случае ячейка представляет собой ромб с острым углом равным шестидесяти градусам, и длиной стороны, равной удвоенному радиусу бусины.
Начинаем строить второй монослой. Его укладываем на первый монослой, при этом одну бусинку мы укладываем на первый слой так, чтобы она соприкасалась с нашей центральной. А значит она у нас расположится во впадине. Вокруг центральной бусины у нас располагаются шесть впадин, а расстояние между ними чуть больше радиуса бусины. Значит во втором слое бусин с центральной бусиной у нас соприкоснуться уже три бусины, вместо шести (обозначим их как 7-9). Хорошо видно, что три бусины второго слоя можно расположить несколькими способами:
Типы кристаллических решеток
- помещаем их во впадины между Ц, 1, 2; Ц 3,4; Ц,5,6;
- помещаем в углубления Ц, 2, 3; Ц, 4, 5; Ц, 1, 6;
По отношению к центральной бусине все варианты абсолютно одинаковые. Давайте возьмем первый слой размещения бусин для второго монослоя. Так как центры частиц первого и второго слоев не совпадают, то сетка второго слоя смещена относительно первого.
Начинаем заполнять третий слой после второго. Тут тоже есть два варианта расположения. Они абсолютно неидентичных между собой. В первом случае бусина помещается в впадину А и тогда у нас сетка сдвигается на треть. Очерчиваем мысленно окружность вокруг точки А и понимаем, что в этом случае сетка четвертого слоя совпадает с первым слоем.
Другой случай – это расположение бусин третьего слоя во впадинах Б. В таком случае сетка третьего слоя совпадает с сеткой первого, а сетка второго – с стекой четвертого.
То есть у нас существует несколько типов упаковки бусин в виде чередования слоев. Это 1, 2,1,2,1,2 и 1,2,3,1,2,3,1,2,3.
В первом случае – речь идет о так называемой гексагональной упаковке, а во втором о кубической.
Большое количество металлов кристаллизуются по одному из этих типов плотной упаковки.
При этом как бы не старались заполнить пустоты бусинами, все равно часть пространства будет пустым. А теперь посмотрим на бусины через боковые стенки сосуда. Видно, что три бусины одного слоя и одна другого образуют систему за которой, скрывается пустота. Центры этих четырех бусин располагаются в вершинах тетраэдра , а значит пустота именуется тетраэдрической.
Типы кристаллических решеток. 8 класс.
Октаэдрический тип –это образование пустоты между тремя бусинами одного слоя и тремя другого.
Роль таких пустот чрезвычайно важно при образовании кристалла частицами с разным размером. В этом случае у нас частицы с большим радиусом располагаются так, чтобы получилась плотная упаковка, а меньшие располагаются в образованных этими частицами пустотами.
Совокупность сеток, советующих всем слоям частиц кристалла, представляет собой пространственную систему, именуемой кристаллической решеткой. Среди характеристик сетки можно выделить параметры ячейки ее размеры, сторон и величину углов. Существует огромное множество форм кристаллических решеток. Изучением кристаллических решеток занимается кристаллография.
А теперь давайте рассмотрим кристалл не с точки зрения его «устройства», а с точки зрения химических сил, обеспечивающих связь в этих кристаллах.

Типы химической связи
По характеру связи между частицами кристаллы подразделяются на четыре вида: молекулярные, атомные, ионные и металлические. Конечно, вы помните, что не может быть стопроцентной одной связи (только ионной или только металлической, важно какой вид преобладает). Давайте рассмотрим каждый тип подробно.
Молекулярная кристаллическая решетка
Молекулярная решетка в своих узлах имеет молекулы. Связь между молекулами обеспечивается за счет Ван-дер-Вальсового взаимодействия. Это достаточно слабые взаимодействие, поэтому внутримолекулярные и межмолекулярные расстояния между атомами абсолютно разные. За счет малой энергии ван-дер-ваальсового взаимодействия по сравнению с ковалентной связью в молекулах, кристаллы с молекулярным типом кристаллической решетки легко переходят в газообразное состояние при достаточно низких температурах. Большинство органических соединений имеют молекулярный тип решетки из неоргаников — это водород, сера, вода, азот, иод.
Атомная кристаллическая решетка
Атомный тип кристаллической решетки. К таким кристаллам относится алмаз, атом углерода в котором окружен четырьмя другими атомами, равноудаленных от него. Все связи между атомами имеют одинаковую длину и равную энергию. Атомный кристалл характеризуется единой системой химических связей. Атомы связаны направленными, локализованными ковалентными связями.
Они определяют энергетические характеристики кристалл, группировки атомов. Ковалентные связи в атомных решетках имеют высокую прочность, соответственно разрушить подобный кристалл весьма проблематично, особенно по сравнению с молекулярным. Вещества с атомными решетками имеют высокую прочность, и высокую температуру плавления и кипения.

Ионная кристаллическая решетка
Ионная кристаллическая решетка образуется чередующимися ионами противоположными по знакам. К примеру, кубический кристалл хлорида натрия (поваренная соль) относится к классическому примеру ионного кристалла. В ионной решетке нет возможности вычленить отдельную молекулу хлорида натрия – все ионы кристалла взаимодействуют между собой.
То есть любой положительный ион натрия притягивает отрицательно заряженный ион хлора и отталкивает другие ионы натрия. Каждый ион в кристалле образует сферически симметричное электростатическое поле, взаимодействие между ионами происходит за счет кулоновских сил. Число соседей каждого иона определяется соотношением размеров ионов и принципом электронейтральности.
Энергетической характеристикой ионного кристалл является энергия ионной кристаллической решетки.
Энергия ионной кристаллической решетки – это энергия образования одного моля кристаллического вещества из свободных газообразных ионов. Рассчитывается исходя из законов электростатики, либо по циклу Борна-Габера.
Энергия ионной решетки сопоставима с энергией химических связей в атомных кристаллических решетках, что обуславливает достаточно прочные кристаллы и трудное их разрушение.
Металлическая кристаллическая решетка
Металлические кристаллические решетки имеют существенное отличие от молекулярных и атомных решеток. Кристаллы обладают характерным блеском, легко деформируются обладают высокими показателями теплопроводности и электропроводности. В металлическом кристалле атомы связаны друг с другом тем прочнее, чем больше электронов участвует в образовании связей. Это объясняет наличие в ряду металлов легкоплавки и легколетучих ( ртуть), щелочные металлы.
Надеемся мы смогли вам объяснить «на пальцах» очередной материал, необходимый для успешной подготовки к сдаче ЕГЭ по химии за минимальный срок.
Источник: thestudyway.com
Золото тип кристаллической решетки ионная
Химическая связь может возникнуть при электростатическом притяжении двух разноименных ионов — катиона и аниона, например, K + и I − . Перекрывание атомных орбиталей в этом случае незначительно, и электронная плотность распределена неравномерно, недостаток её будет у атома калия, а избыток — у атома иода.
Ионную связь (K + )−(I − ) рассматривают как предельный случай ковалентной связи.
Общая пара электронов в случае ионной связи практически полностью смещена к аниону. Обычно это происходит в соединениях элементов с большой разностью электроотрицательности (например, в соединениях CsF, NaBr, K2O, Rb2S, Li3N и др.).
Все эти соединения при обычных условиях представляют собой ионные кристаллы (кристаллы, построенные из катионов и анионов), например кристаллы иодида калия или хлорида натрия.
Металлическая связь. Металлические кристаллы

В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства — узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Атомные и молекулярные кристаллы
В твердом агрегатном состоянии у веществ могут образоваться не только ионные, но также молекулярные и атомные кристаллические решетки.
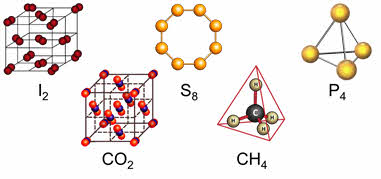
Так, твердый иод имеют молекулярную кристаллическую решетку, в узлах которых находятся молекулы I2.
Аналогичным образом построена кристаллическая решетка твердого диоксида углерода (сухой лед) — в узлах кристаллической решетки находятся молекулы CO2.
Алмаз и графит — кристаллы с атомной решеткой, имеющей в узлах атомы углерода с разным расположением этих узлов в пространстве.
| кристаллическая решетка алмаза | кристаллическая решетка графита |
Водородная связь
При изучении многих веществ были обнаружены так называемые водородные связи.
Например, молекулы HF в жидком фтороводороде связаны между собой водородной связью, аналогично связаны молекулы Н2О в жидкой воде или в кристалле льда, а также молекулы NH3 и Н2О между собой в межмолекулярном соединении — гидрате аммиака NH3 · Н2О.
Водородная связь образуется за счёт сил электростатического притяжения водородсодержащих полярных молекул, содержащих атомы наиболее электроотрицательных элементов — F, O, N. Например, водородные связи имеются в HF, Н2О, NH3, но их нет в HCl, Н2S, PH3.
Водородные связи малоустойчивы и разрушаются довольно легко (например при плавлении льда, кипении воды). Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без водородных связей:
Источник: www.alhimik.ru
Типы кристаллических решёток»
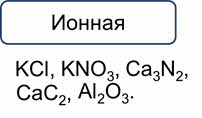
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.

Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.

У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.
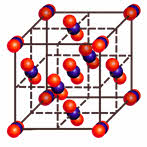
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
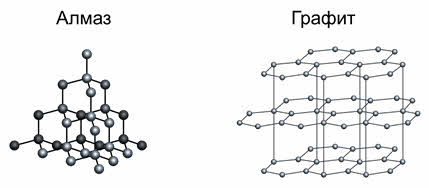
Как известно, твёрдость алмаза оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но, несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.

Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.

У веществ с ионным типом связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.
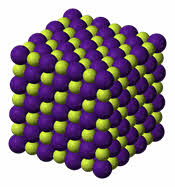
Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
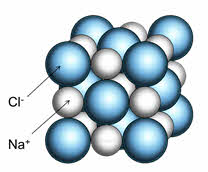
Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.
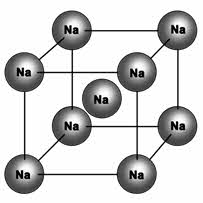
Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
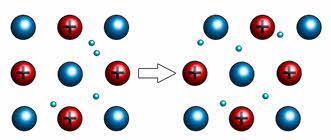
Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
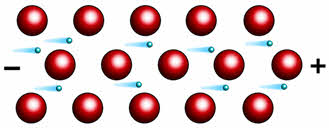
Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность металлов также объясняется движением свободных электронов, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
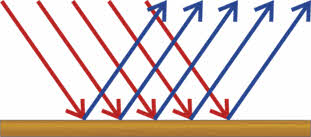
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.

Источник: helpiks.su